7.5.3 Mischkristallbildung bei Ionengittern
Wir haben die Mischkristallbildung bei Metallgittern bereits kennengelernt (vgl. Band 2). Alle dort erläuterten Überlegungen und Beschreibungsweisen können für Ionengitter direkt übernommen werden - wir müssen jedoch zusätzlich einen Ausgleich der Anziehungs- und Abstoßungskräfte der Ionen im Ionengitter berücksichtigen.
Nachdem zur Verknüpfung von Ionen gründsätzlich mindestens zwei Ionenarten verwendet werden müssen und die kleinere Ionensorte häufig in Lücken eingebaut bzw. eingelagert wird, spielt bei der Mischkristallbildung weniger die Einlagerung von Ionen, sondern eher die Substitution der Ionen in einem bestehenden Ionengitter die wichtigste Rolle.
Ob wir nun Anionen oder Kationen austauschen: die Größe der Ionen spielt eine entscheidende Rolle, die Abweichungen der Ionenradien dürfen im allgemeinen 6 - 10 % nicht überschreiten. Außerdem müssen wir für den Ausgleich der Ladungen sorgen: das ist am einfachsten durch Wahl gleicher Ionenladung des auszutauschenden Teilchens möglich. Weiterhin eröffnen sich aber auch viele neue Möglichkeiten des Teilchenaustausches durch geschicktes Kombinieren von Ionen unterschiedlicher Ladung oder durch Auslassen beim Besetzen von Gitterplätzen. Einige aus der Vielfalt herausgegriffene Beispiele sollen diese Möglichkeiten verdeutlichen.
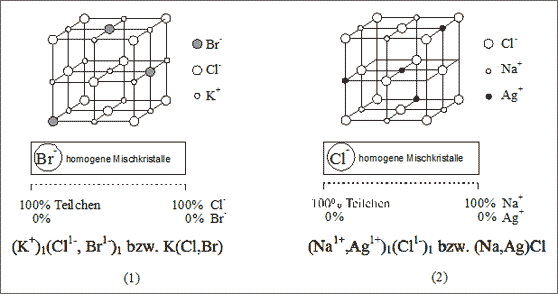
Abb. 7.25: Modellvorstellungen zur lückenlosen Substitutionsmischkristall-Bildung
Austausch des Anions. Kalium-Ionen K1+ und Chlorid-Ionen Cl1- lassen sich ebenso wie Kalium-Ionen K1+ und Bromid-Ionen Br1- in der Struktur des Kochsalzgitters zusammensetzen. Nehmen wir an, wir besitzen bereits einen Kristall der Zusammensetzung (K1+)1(Cl1-)1, er wird Kaliumchlorid oder Sylvin benannt. Durch Herausnahme eines Chlorid-Ions und Ersatz durch ein Bromid-Ion beginnt die Mischkristallbildung. Dieser Austausch kann so lange durchgeführt werden, bis alle Chlorid-Ionen durch Bromid-Ionen ersetzt sind: ein Kristall der Zusammensetzung (K1+)1(Br1-)1 bzw. KBr entsteht, der Name ist Kaliumbromid.
Diese Mischkristallbildung ist wie bei Legierungskristallen von Metallen anhand eines Konzentrationsbandes darstellbar. Prozentangaben beziehen sich in unserem Fall auf Teilchenanzahlen (vgl. (1) in Abb. 7.25). Es muß angegeben werden, daß die Kalium-Ionen ihre Plätze beibehalten. Das Summensymbol für diese Mischkristalle wird als (K+)1(Cl-, Br-)1 bzw. K(Cl,Br) angegeben.
Im Mineral Carnallit ist häufig ein Teil der Chlorid-Ionen gegen Bromid-Ionen ausgetauscht. Der Kristall wird dann Bromcarnallit genannt und mit dem Summensymbol (K1+)1(Mg2+)1(Cl,Br)3 bzw. KMg(Cl,Br)3 bezeichnet. Sowohl Carnallit als auch Bromcarnallit findet man in großen Mengen in den Kalisalzlagerstätten (beispielsweise in Lehrte bei Hannover).
Austausch des Kations. Silber-Ionen Ag1+ bilden mit Chlorid-Ionen Cl1- ein Kochsalzgitter wie Natrium-Ionen Na1+ und Chlorid-Ionen Cl1-. Natrium-Ionen und Silber-Ionen können sich in diesem Gitter in jedem Zahlenverhältnis vertreten. Durch kontinuierliches Ersetzen der Natrium-Ionen durch Silberionen erhalten wir eine homogene Mischkristallreihe, wobei die Eigenschaften des Kochsalzkristalls mit fortschreitendem Austausch gegen Silber-Ionen völlig fließend in die Eigenschaften des Kristalls der Zusammensetzung (Ag1+)1(Cl1-)1 bzw. AgCl mit Namen Silberchlorid übergehen. Die Beschreibung anhand des Konzentrationsbandes erfordert den Hinweis, daß die Chlorid-Ionen ihre Plätze beibehalten (vgl. (2) in Abb. 7.25). Das Summensymbol lautet (Na1+,Ag1+)1(Cl1-)1 bzw. (Na,Ag)Cl.
Eisen-Ionen Fe3+ fügen sich mit Oxid-Ionen im Korundgitter als Hämatit zusammen, Titan-Ionen Ti3+ bilden mit Oxid-Ionen ebenfalls die Korundstruktur. Obwohl das Ti3+-Ion mit einem Ionenradius von 76 pm erheblich größer ist als das Fe3+-Ion mit 64 pm, können sich die beiden Teilchen gegenseitig völlig zu einer homogenen Mischkristallreihe ersetzen: das Symbol lautet (Fe3+,Ti3+)2(O2-)3 bzw. (Fe,Ti)2O3.
Wenn die Hälfte der in der Korundstruktur verfügbaren Oktaederlücken mit Fe3+-Ionen und die andere Hälfte mit Ti3+-Ionen besetzt ist, nennt man diesen Kristall Ilmenit, das Symbol lautet FeTiO3. Ilmenit findet sich in der Natur als Mineral und wird zur Titangewinnung bergmännisch abgebaut.
Außer dem Fe3+-Ion ist das Fe2+-Ion ebenfalls häufig anzutreffen und neben dem hier genannten Ti3+-Ion ist uns im Rutil bereits das Ti4+-Ion begegnet. Wie wir später sehen werden, können sich ein Fe2+-Ion und ein Ti4+-Ion in zwei Ionen mit der gemittelten Ionenladung 3+ umwandeln und umgekehrt ein Fe3+-Ion zusammen mit einem Ti3+-Ion wieder „rückwärts“ in ein Fe2+-Ion und ein Ti4+-Ion. Insofern ist es gar nicht so eindeutig zu entscheiden, ob wir im Ilmenit die Eisen- und die Titan-Ionen nur als dreifach positiv oder die Eisen-Ionen zweifach und die Titan-Ionen als vierfach positiv beschreiben sollen. Die Mischkristallbildung mit Hämatit spricht für Ti3+-Ionen, der weitere Ersatz von Eisen-Ionen durch Ni2+-Ionen für Fe2+-Ionen. Offensichtlich gibt sich ein Zwillingspaar von Ti4+-Ion und Fe2+-Ion je nach Gegebenheiten wie ein Chamäleon aus! Diese Erscheinung wird uns bei anderen Ionenpaaren ebenfalls immer wieder begegnen.
Kristalle, bei denen dieses "Chamäleonverhalten" von Ionenpaaren gegeben ist, sind meistens sehr intensiv gefärbt. Chrom-Ionen Cr3+ können beispielsweise die Aluminium-Ionen Al3+ im Korund ersetzen. Die Kombination von Cr3+-Ionen und Oxid-Ionen allein in der Korundstruktur ergibt als Substanz dunkelgrüne Kristalle, das Symbol lautet (Cr3+)2(O2-)3 bzw.Cr2O3. Insofern erhält auch ein Korund, bei dem ein größerer Anteil an Aluminium-Ionen durch Chrom-Ionen ersetzt ist, eine grüne Farbe.
Ersetzt man aber nur etwa jedes tausendste bis zweitausendste Al3+-Ion durch ein Cr3+-Ion, dann erhält der Korundkristall eine schöne rote Färbung und wird Rubin genannt. Ersetzt man im Korund genauso vereinzelt wie im Rubin Al3+-Ionen durch Fe2+-, Ti4+- und Fe3+ Ionen, dann wird der Kristall je nach Anzahl der substituierten Ionen bis zu tiefblau gefärbt, er besitzt den Namen Saphir. Sowohl Rubin als auch Saphir sind als Halbedelsteine sehr geschätzt.
Substitutionsmischkristalle mit begrenztem Konzentrationsbereich. Sowohl Na+-Ionen als auch Rubidium-Ionen Rb+ bilden mit Iodid-Ionen I- ein Kochsalzgitter. Die Natrium-Ionen besitzen einen Ionenradius von 98 pm, die Rubidium-Ionen einen solchen von 149 pm: Rubidium-Ionen sind dementsprechend um ein Drittel größer als Natrium-Ionen. Wenn wir nun beginnen, im (Na1+)1(I1-)1 bzw. im NaI-Gitter die Natrium-Ionen durch Rubidium-Ionen zu ersetzen, so ist das bis zu 10 Teilchenprozent möglich. Die gesamte Gitterbauweise wird aber durch die hinzukommenden Rubidium-Ionen mehr und mehr verspannt und verzogen, sodaß ab etwa 10% der ausgetauschten Teilchen das Gitter nicht mehr zusammenhält.
Den gleichen Sachverhalt finden wir, wenn in einem Rubidiumiodid-Kristall (Rb1+)1(I1-)1 bzw. RbI die Rb1+-Ionen durch Na1+-Ionen ersetzt werden. Die Natrium-Ionen sind soviel zu klein, daß nach anfänglichem Austausch von bis zu 20% der Rubidium-Ionen die Stabilität der Gitterbauweise nicht mehr gewährleistet ist. Die beiden Mischkristalle sind durch eine Mischungslücke im Konzentrationsbereich getrennt, die Darstellung anhand des Konzentrationsbandes ist völlig der Beschreibungsweise der Metallgitter analog (vgl. (Abb. 7.26). Als Symbol für diese Mischkristallreihe wird (Na1+, Rb1+)1(I1-)1 bzw. (Na,Rb)I verwendet.
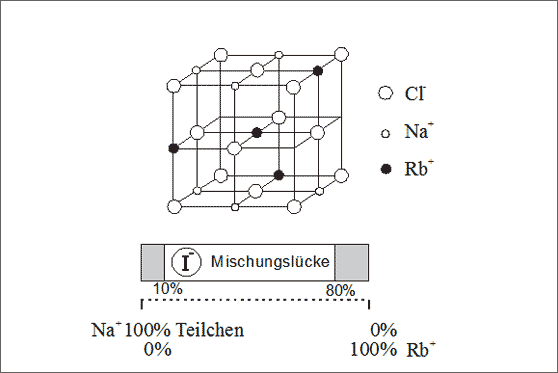
Abb. 7.26: Modellvorstellungen zu Mischungslücken bei Substitutionsmischkristallen
Leerstellen infolge der Substitution. Zur Beschreibung des Zinkblende-Gitters ZnS kann man vom Lithiumoxid-Gitter Li2O ausgehen: nehmen wie aus den voll besetzten Tetraederlücken der kubisch dichtesten Packung von Oxid-Ionen die Li+-Ionen heraus und setzen zweifach positiv geladene Zn2+-Ionen dafür hinein, so darf die Anzahl der Zink-Ionen nur die Hälfte der Anzahl der Lithium-Ionen betragen. Insofern erhalten wir zu jeder neu besetzten Tetraederlücke gleichzeitig einen leeren Lückenplatz. Werden schließlich die Oxid-Ionen durch Sulfid-Ionen S2- ersetzt, so ist das Zinkblende-Gitter fertig. Wir können versuchen, die leeren Lücken zur Information in das Summensymbol mit aufzunehmen: im Zinksulfid gibt es genauso viele leere Tetraederlücken wie Zink-Ionen (vgl. Abb. 7.7). Verwenden wir für eine leere Tetraederlücke ein Dreieck, dann erhalten wir ein Summensymbol (Zn2+)1(Δ)1(S2-)1 bzw. ZnΔS.
Zur Beschreibung des Gitters von Cadmiumchlorid kann man vom Kochsalz-Gitter ausgehen: entfernt man zwei Na+-Ionen aus jeweils zwei Oktaederlücken und besetzt eine der Lücken neu mit euinem Cd2+-Ion, so bleibt je Cadmium-Ion eine Oktaederlücke unbesetzt, wir erhalten je Cadmium-Ion eine Leerstelle. Versuchen wir auch diese leeren Oktaederlücken mit in das Symbol mit aufzunehmen und wählen wir als Zeichen für eine Oktaederlücke ein Quadrat ❑, so lautet das neue Symbol für das Cadmiumchlorid-Gitter (Cd2+)1(❑)1(Cl1-)2 bzw. Cd❑Cl2.
Genauso können wir die Information für das Spinell-Gitter MgAl2O4 erweitern. Wir nehmen die pro Elementarzelle jeweils sieben leeren Tetraederlücken und die jeweils zwei leeren Oktaederlücken mit in das Symbol auf und erhalten (Mg2+)1(Δ)7(Al3+)2(❑)2(O2-)4 bzw. MgΔ7Al2❑2O4.
Entscheidend bei solch einer Information über die Lücken in Ionengittern ist aber immer die Angabe des Bezugsgitters, auf das die leeren Lücken bezogen sein sollen. Ohne eigens noch einmal darauf hinzuweisen, war dies bei unseren Beispielen immer die kubisch dichteste Packung von Ionen. Legen wir die Spinell-Struktur mit den entsprechenden Oktaeder- und Tetraederlücken zugrunde, so beziehen sich „verfügbare Lücken“ natürlich auf diese Lücken in dieser Struktur.
Die Fragestellung ist bereits bei der Bauweise von Fe3+-Ionen mit Oxid-Ionen in der Spinellstruktur aufgetreten: eigentlich sind ausschließlich dreifach positiv geladene Ionen nicht für die Spinellstruktur vorgesehen. Wenn man aber die Spinell-Struktur erzwingt, dann muß ein Sechstel der verfügbaren Oktaederlücken unbesetzt bleiben - verfügbar bedeutet hier also auf die Spinellstruktur bezogen. Verwenden wir wieder für eine Oktaederlücke das Quadratzeichen ❑, so können wir ein Symbol (Fe3+)3(Fe3+)5(❑)1(O2-)12 formulieren. Wenn wir es anhand des verkürzten Symbols angeben, dann erhalten wir (Fe3+)1(Fe3+)1,66(❑)0,33(O2-)4 bzw. Fe2,66 ❑0,33O4 .
Als weiteres Beispiel sei die Kombination von Fe2+-Ionen und Oxid-Ionen erwähnt. Beide Ionensorten setzen sich in der Art des NaCl-Gitters zusammen: die Oxid-Ionen bilden eine kubisch dichteste Packung und die Eisen-Ionen besetzen die Oktaederlücken. Zum Bau des Gitters wird demnach die gleiche Anzahl von Fe2+-Ionen benötigt wie Oxid-Ionen, das Symbol lautet (Fe2+)1(O2-)1 bzw. FeO.
In der Praxis werden die Oktaederlücken aber immer auch von Fe3+-Ionen besetzt: ab und zu werden also nur zwei Lücken von Fe3+-Ionen besetzt anstatt drei Lücken von Fe2+-Ionen. Die jeweils dritte Lücke bleibt dann leer. Machen wir uns diesen Sachverhalt an einem Beispiel mit einer größeren Anzahl von Ionen deutlich.
Gehen wir von 100 Oxid-Ionen aus, die bekannterweise 100 Oktaederlücken bilden. Nehmen wir an, 70 Lücken sind mit Fe2+-Ionen besetzt: es resultiert eine positive Gegenladung von +140 zu den 200 negativen Ladungen der Oxid-Ionen. Es fehlen zum Ausgleich noch 60 positive Ladungen, die wir durch 20 Fe3+-Ionen bereitstellen können anstelle von 30 Fe2+-Ionen. Dann bleiben allerdings 10 Oktaederlücken leer. Stellen wir die Überlegung zusammen:
| Anzahl der Ionen | Gesamtladung |
| 100 O2—Ionen | -200 |
| 70 Fe2+-Ionen | +140 |
| 20 Fe3+-Ionen | +60 |
| 10 # Leerstellen | 0 |
| Summe | 0 |
Als Summensymbol bietet sich demnach an: (Fe2+)70(Fe3+)20(❑)10(O2-)100. Durch ständige Vereinfachung des Symbols erhalten wir (Fe2+)0,7(Fe3+)0,2(❑)0,1(O2-)1 bzw. Fe0,7Fe0,2❑0,1O1 bzw. Fe0,9O. Das letztgenannte Symbol Fe0,9O ist nicht mehr informativ ohne entsprechendes Hintergrundwissen über den Gitteraufbau, erleichtert aber die Information der Kenner untereinander.
Wir hätten das Summensymbol auch Fe1,00O1,11 angeben können, da das Ionenverhältnis 0,9:1,0 erhalten ist. Wenn aber eine Bausteinsorte alle Gitterplätze einnimmt und die andere Bausteinsorte Lücken läßt, wird die lückenlos bauende Sorte gerne als Bezug genommen. Fe1,00O1,11 würde für den geübten Symbolleser ein exaktes Eisen-Ionengitter mit einem Zuviel an Oxid-Ionen signalisieren, Fe0,9O1,0 dagegen ein intaktes Gitter von Oxid-Ionen mit einem Zuwenig an besetzten Plätzen mit Eisen-Ionen. Da letzteres zutrifft, ist das Summensymbol Fe0,9O1,0 bzw. Fe0,9O üblich.
Die am Fe0,9O-Gitter beschriebene Erscheinung, daß Gitterplätze in einer Struktur nicht vollständig besetzt sind, ist bei vielen Ionenkristallen anzutreffen. Auch das entgegengesetzte Phänomen, daß eine Bausteinsorte ihr Teilgitter durch Inanspruchnahme von vorhandenen Lücken überbesetzt, spielt etwa für die elektrischen Eigenschaften der Kristalle, unter anderem für die sogenannten Halbleitereigenschaften, eine ganz bedeutende Rolle.
![]()


