7.6 Übersicht über die Typen von Ionengittern
Wir haben bislang etwa 20 verschiedene Typen von Ionengittern kennengelernt. Entscheidend ist nun, daß viele andere Ionenkombinationen, die wir nicht aus-drücklich erläutert haben, in den beschriebenen Gitteranordnungen kristallisieren. Beispielsweise können Lithium-Ionen Li1+ zusammen mit Aluminium-Ionen Al3+ und Oxid-Ionen O2- die Gitterplätze einnehmen, wie es die Ionen im Kochsalz-Gitter tun: die Oxid-Ionen nehmen die Plätze der Chlorid-Ionen, die Lithium- und Aluminium-Ionen abwechselnd die Plätze der Natrium-Ionen. Das Symbol lautet dann (Li1+)1(Al3+)1(O2-)2 bzw. LiAlO2. Die Orientierung der Gitterbauweise erfolgt, wenn möglich, an einer bekannten Gitterstruktur, hier am Natriumchloridgitter. Diese "Orientierungsgitter" werden als Gittertypen bezeichnet - in der Fachliteratur der Kristallographen sind sie sogar numeriert.
Wir haben die verschiedenen Ionengitter anhand von bestimmten Ionensorten vorgestellt, an denen entsprechende Gitter historisch das erste Mal vermessen worden sind. Diese sind dann auch die bekannten Gittertypen geworden. Man sagt eben nicht, NaCl hat eine Gitteranordnung wie LiAlO2, sondern das Gitter von LiAlO2 ist im NaCl-Typ gebaut. Insofern übernehmen fast alle bisher vorgestellten Gitterkonstruktionen die Funktion bekannter Gittertypen. In Nachschlagewerken sind viele Substanzen nach solchen Gittertypen geordnet. Nachfolgende Tabelle führt für vier Gittertypen beispielhaft einige Ionengitter in der Art solcher Lexika auf.
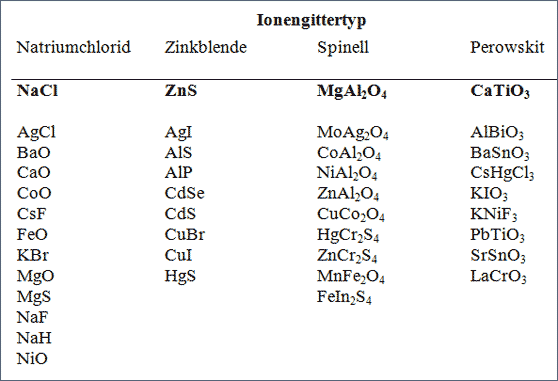
Tab. 7.3 Vier bekannte Ionengitter-Strukturen und Beispiele für abgeleitete Gitter
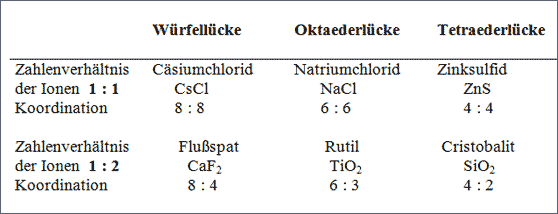
Tab. 7.4 Typen von Ionengittern in Abhängigkeit von Ladungszahl und Radienverhältnis
Eine andere Übersicht über die einfachsten Gittertypen erhält man, wenn man vom Ladungsverhältnis der Ionen und dem Radienverhältnis der Ionen ausgeht und dieses Verhältnis den entsprechenden Polyedern Würfel, Oktaeder und Tetraeder zuordnet (vgl. Abb. 7.1 und Tab. 7.1). Die Abhängigkeit von den Ionenzahlen-verhältnissen 1 : 1 und 1 : 2 und die Zuordnung zu Würfel-, Oktaeder- und Tetraederlücke ergibt sechs Gittertypen gemäß abgebildetem Schema (vgl. Tab. 7.4).
Die weiteren uns hier interessierenden Gittertypen kann man anhand der dichtesten Kugelpackungen systematisch überblicken: als Kennzeichen dienen Art gefüllter Lücken und Füllungsgrad (vgl. Tab. 7.5).
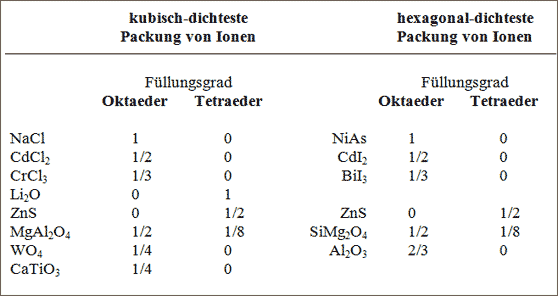
Tab. 7.5 Typen von Ionengittern in Abhängigkeit von Lückenfüllung und Füllungsgrad
Liebe Leser, mit der Verknüpfung einfacher Ionen zu Ionengittern im vor-liegenden Band 4 haben Sie exemplarisch den Aufbau vieler Salzkristalle kennengelernt. Nach der Verknüpfung von Metall-Atomen (Band 2) und von Nichtmetall-Atomen (Band 3) kennen Sie damit die wichtigsten Strukturen, die von Atomen und Ionen als einfachen Gitterbausteinen der Materie ausgehen.
Im Band 5 sollen Ionenkristalle mit zusammengesetzten Gitterbausteinen vorgestellt werden: etwa Sulfate, Carbonate, Nitrate oder Silikate. Es wird dabei möglichst auf Grundstrukturen und Kugelpackungen zurückgegriffen, wie sie in den vorliegenden Bänden erarbeitet worden sind. In jedem Fall soll die Beschreibung der Strukturen wieder so erfolgen, daß Sie entsprechende Modelle nachbauen und damit die Strukturen verstehen können – insofern also auch in die Welt dieser Substanzen quereinsteigen können.
![]()


