7.4.2 Zahlenverhältnis der Ionen von 1 : 2
Um Ionengitter im Ionenzahlenverhältnis von 1 : 2 zu erhalten, müssen Kationen und Anionen verknüpft werden, die sich in der Normladung wie 2 : 1 verhalten, etwa Ladungszahlen aufweisen, die beispielsweise 1+/2- oder 4+/2- lauten.
Man kann zur Konstruktion von Ionengittern im Zahlenverhältnis von 1 : 2 bei den Strukturmerkmalen von Würfel-, Oktaeder- und Tetraederlücke bleiben - wir können entweder bei den Konstruktionen im Zahlenverhältnissen 1 : 1 systematisch jeden zweiten Platz einer Ionensorte auslassen oder, wenn möglich, jeden zweiten Platz zusätzlich füllen.
Je nachdem, nach welchem System wir die Ionen auslassen oder auffüllen, gelangen wir zu ebenen Schichtstrukturen oder völlig gleichmäßigen Raumstrukturen. Wenn wir beispielsweise in der Stapelrichtung von einzelnen Ionenschichten jede zweite Ionenschicht auslassen, erhalten wir sich wiederholende Schichtpakete wie bei einem Sandwich. Wenn wir dagegen in allen drei Raumrichtungen abwechselnd einen Platz, der in einer bestimmten Raumstruktur durch ein Ion besetzt ist, unbesetzt lassen, erhalten wir wiederum eine gleichmäßige Raumstruktur.
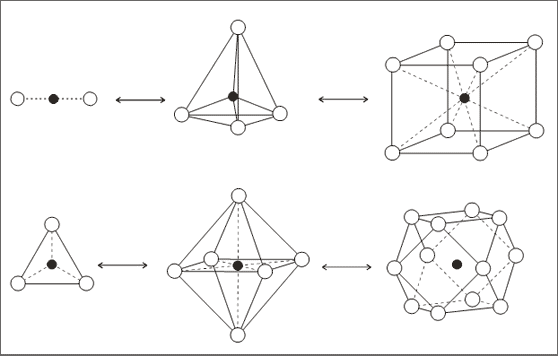
Abb. 7.9: Modellvorstellungen zur Umwandlung von 1:1 -Strukturen in 1:2 - Strukturen
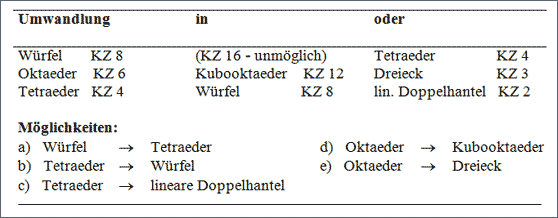
Tab. 7.2: Zusammenhänge von 1 : 1- Strukturen und 1 : 2 – Strukturen (vgl. Abb. 7.9)
Bei einer gleichmäßigen Raumstruktur des Zahlenverhältnisses 1 : 2 müssen sich die Koordinationszahlen der beiden beteiligten Ionenarten ebenfalls wie 1 : 2 verhalten: um das höher geladene Ion müssen doppelt so viele niedrig geladene Ionen gruppiert sein, wie es bei höher geladenen Ionen um ein niedriger geladenes Ion der Fall ist. Damit wird erreicht, daß sich die verfügbare Ladung um alle Ionen gleichmäßig verteilt.
Geht man von Strukturen mit dem Zahlenverhältnis 1 : 1 der Teilchen aus, so können diese gedanklich auf der Grundlage des Vergleichs von Koordinationszahlen in 1 : 2 - Strukturen umgewandelt werden (vgl. Tab. 7.2 und Abb. 7.9). Das wird an einigen Beispielen wie Flußspat, Rutil und anderen ausführlich gezeigt.
Beispiel Flußspat. Wir können zunächst von der Struktur des Cäsiumchlorids ausgehen und gedanklich alle Chlorid-Ionen an den Würfelecken durch Fluorid-Ionen ersetzen (vgl. (a) in Abb. 7.10): jede zweite Würfellücke wird abwechselnd in den drei Raumrichtungen durch Calcium-Ionen besetzt. Dadurch sind um ein Ca2+-Ion würfelförmig acht F--Ionen gelagert, um ein F--Ion tetraedrisch vier Ca2+-Ionen. Um ein Ca2+-Ion herrscht die Gesamtladung 8- von acht Fluorid-Ionen und um ein F--Ion die Gesamtladung von 8+ von vier Calcium-Ionen.
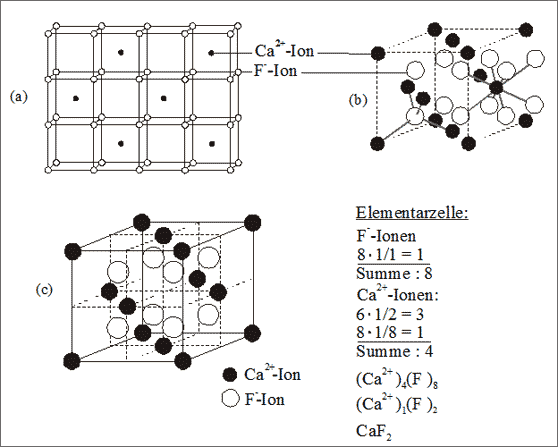
Abb. 7.10: Modellvorstellungen zum Flußspat-Gitter (CaF2)
Erstaunlich ist bei dieser Konstruktion, daß die Calcium-Ionen kubisch flächenzentriert angeordnet sind (b). Wir können deshalb das Flußspatgitter auch ausgehend vom Zinkblende-gitter beschreiben, indem wir die vier leeren Tetraederlücken in dem diesbezüglichen Elementarwürfel ebenfalls besetzen und sehen, daß Fluorid-Ionen die Plätze aller Tetraederlücken einnehmen (b). Es sei darauf hingewiesen, daß Calcium-Ionen kleiner sind als Fluorid-Ionen und deshalb keine kubisch dichteste Packung bilden - sie besitzen nur deren Anordnung.
Die Bilanz der Elementarzelle weist das Summensymbol (Ca2+)1(F1-)2 bzw. CaF2 aus (vgl. (c) in Abb. 7.10). Wenn man das Summensymbol CaF2 diesbezüglich richtig interpretieren will, braucht man bereits ein gediegenes Hintergrundwissen. Ein unbedarfter Adressat dieser Information kann aus dem Symbol die unsinnigsten Schlüsse ziehen, wenn er etwa im Flußspatkristall F2-Hanteln, also Moleküle vermutet! Deshalb auch hier wiederum der Hinweis: die Information muß immer auf den Adressaten abgestimmt sein.
Flußspat, auch Fluorit genannt, bildet schöne würfelige Kristalle, die man mit Hammer und einem stabilen Messer in Oktaeder spalten kann. Völlig reine Kristalle sind farblos. Durch Austausch von Ionen auf den Gitterplätzen in geringer Anzahl wird die Farbe gelb, braun, grün und violett. Wenn man den Fluorit im Dunkeln mit ultraviolettem Licht bestrahlt, leuchtet er magisch mit eigenartiger bläulich-grüner Farbtönung auf. Diese Erscheinung wird als „Fluoreszenz“ bezeichnet - man hat sie auch bei vielen anderen Substanzen gefunden.
Beispiel Rutil. Dieser Kristall baut sich aus Ti4+- und O2--Ionen im Zahlenverhältnis 1 : 2 auf. Geht man von der Oktaederbauweise mit den Koordinationszahlen 6 : 6 aus und will von einer 1 : 1 - Struktur zu einer 1 : 2 - Struktur gelangen, so ist ein möglicher Weg, die oktaedrische Umgebung einer Ionensorte in eine Dreiecksstruktur zu verwandeln (vgl. Tab. 7.2): während sich die kleineren Titan-Ionen oktaedrisch mit sechs Oxid-Ionen verknüpfen, umgibt sich ein Oxid-Ion mit drei Titan-Ionen in Form eines ebenen Dreiecks, als Trigon (vgl. Abb. 7.11).
Die Elementarzelle läßt sich folgendermaßen beschreiben (vgl. (a) in Abb. 7.11): Sie ist tetragonal gebaut, enthält zwei Ti4+-Ionen und vier O2--Ionen: an den acht Ecken befinden sich je 1/8 und im Zentrum ein ganzes Ti4+-Ion. Sechs O2--Ionen sind um das zentrale Ti4+-Ion oktaedrisch gelagert: zur Elementarzelle werden davon 4/2 der Grund- und Deckfläche der Zelle, 2/1 im Inneren der Zelle gerechnet, in der Summe also vier ganze O2--Ionen abgezählt. Das Summensymbol lautet dementsprechend: (Ti4+)2(O2-)4 bzw. (Ti4+)1(O2-)2 bzw. TiO2.
Die quadratische Fläche, die sich ergibt, wenn man den Oktaeder in zwei Hälften schneidet, steht senkrecht zur quadratischen Grundfläche der tetragonalen Zelle, zwei gegenüberliegende Seiten des Quadrats liegen jeweils in der Grundfläche und in der Deckfläche der Zelle. Anders ausgedrückt: zwei gegenüberliegende Kanten des Oktaeders sind parallel in Grund- und Deckfläche der Zelle einbezogen, sodaß die Höhe der Zelle der Kantenlänge des Oktaeders entspricht.
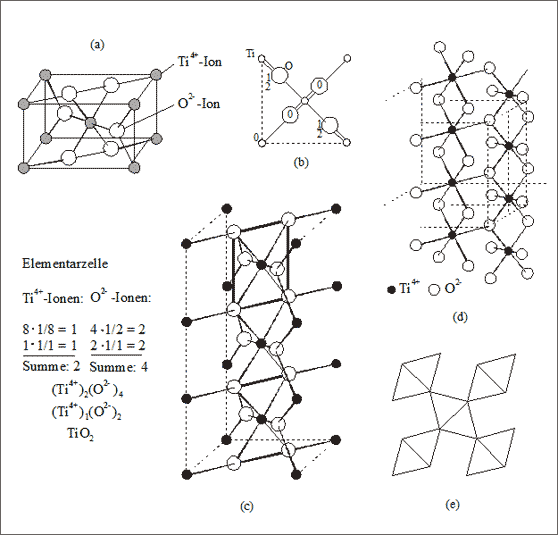
Abb. Abb. 7.11: Modellvorstellungen zum Rutil-Gitter (TiO2)
Diese Kantenlänge entspricht auch dem Abstand zweier O2--Ionen: Somit liegen je zwei O2--Ionen auf Grund- und Deckfläche und zwei in der tetragonalen Zelle auf halber Höhe (vgl. auch (b) der Abb. 7.11).
Die Projektion des Oktaeders über die beiden Kanten auf die Grundfläche der Zelle führt zu einer Raute. Die beiden Ecken, die durch die kürzere Diagonale verbunden werden können, entsprechen je zwei aufeinander projizierten O2--Ionen. Beide Diagonalen der Raute stehen aufeinander senkrecht und zeigen in die vier Ecken der quadratischen Grundfläche der tetra-gonalen Zelle (vgl. (b) der Abb. 7.11).
Diese tetragonalen Zellen können so gestapelt werden, daß die Oktaeder immer Kante mit Kante gekoppelt sind (vgl. (c) der Abb. 7.11). Damit liegen die ebenen Dreiecke, die sich durch drei Ti4+-Ionen um die O2--Ionen bilden, in der Fläche, die man durch einen senkrechten Schnitt durch die tetragonale Zelle entlang der Flächendiagonalen der Quadratfläche erhält.
Die senkrecht gestapelten Oktaeder, die je über eine gemeinsame Kante verknüpft sind, wirken wie Türme, die nach zwei entgegengesetzten Seiten zwei Oktaederspitzen herausschauen lassen. Der Abstand von Oktaederspitze zu Oktaederspitze beträgt in Stapelungsrichtung genau eine Kantenlänge der Oktaeder. Insofern ist es möglich, an einen senkrechten Oktaederturm vier weitere Oktaedertürme zu koppeln. Damit das Kopplungsmanöver gelingt, müssen die Türme in ihrer Höhe um eine halbe Kantenlänge der Oktaeder verschoben werden (vgl. (d) der Abb. 7.11). Die Projektion der gekoppelten Oktaedertürme senkrecht von oben gesehen zeigt (e): Das gestrichelte Quadrat stellt die Projektion der tetragonalen Elementarzelle dar, die Rautenmitten stellen die Projektionen der Ti4+-Positionen, die Rautenecken die Projektionen der O2--Positionen dar.
Beispiel Cadmiumchlorid. Eine weitere Möglichkeit, von der Oktaederbauweise ausgehend eine Umwandlung von einer 1 : 1 - Struktur in eine 1 : 2 - Struktur zu realisieren, erhält man, wenn im Kochsalzgitter die Oktaederlücken nicht vollständig, sondern abwechselnd nur zu Hälfte aufgefüllt werden. Schneiden wir aus dem bekannten Kochsalzgitter eine passende Quadratfläche heraus und entfernen gedanklich jeweils umschichtig eine Reihe von Ionen, die die Oktaederlücken füllen, so erhalten wir eine Struktur, in der nur noch die Hälfte aller Oktaederlücken besetzt ist (vgl. (a) in Abb. 7.12).
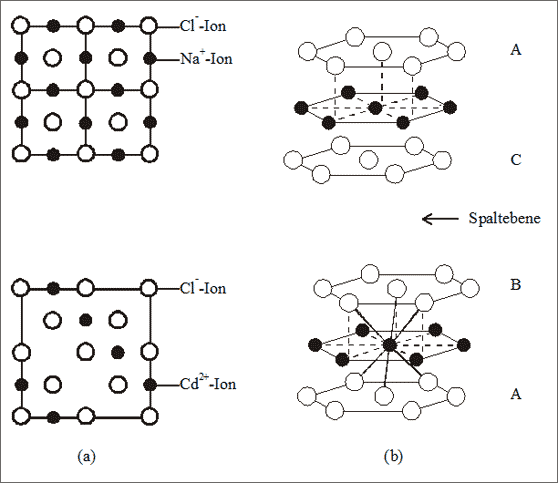
Abb. 7.12: Modellvorstellungen zum Cadmiumchlorid-Gitter (CdCl2)
Betrachten wir den Sachverhalt räumlich: Die Cl--Ionen bilden eine kubisch dichteste Packung in der Schichtbauweise der Dreiecksmaschen ABCABC (vgl. (b) in Abb. 7.12). Füllen wir jede zweite Schicht von Oktaederlücken mit Cd2+-Ionen, so erhalten wir ein Schichtengitter mit dem Namen Cadmiumchlorid: die Schichten, die jeweils leere Oktaederlücken enthalten, entsprechen auch den Spaltebenen der Kristalle. In einer dichtesten Kugelpackung existieren genauso viele Oktaederlücken wie die Kugelpackung aufbauende Bausteine. Daher resultiert bei der Besetzung der Hälfte der Lücken das Summensymbol (Cd2+)1(Cl1-)2 bzw. CdCl2.
Beispiel Cadmiumiodid. Das analoge Gegenstück zum Cadmiumchlorid-Gitter mit kubischer Struktur ist das Cadmiumiodid-Gitter mit hexagonaler Struktur: Die Iodid-Ionen bilden die hexagonal dichteste Packung und die Cadmium-Ionen besetzen schichtweise abwechselnd die Oktaederlücken (vgl. Abb. 7.13). Insofern leitet sich das kubische Cadmiumchlorid-Gitter genauso aus der Kochsalzstruktur ab wie das hexagonale Cadmiumiodid-Gitter aus der Rotnickelkies-Struktur. Das Summensymbol lautet (Cd2+)1(I1-)2 bzw. CdI2 .
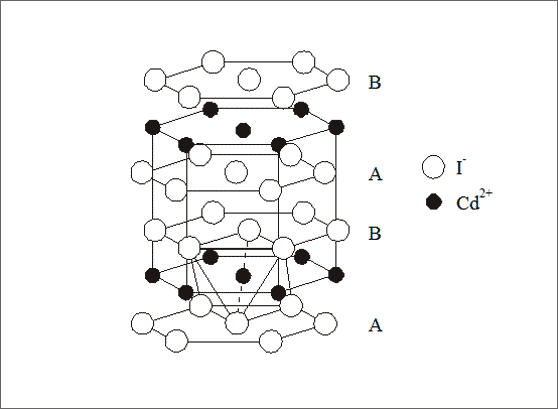
Abb. 7.13: Modellvorstellungen zum Cadmiumiodid-Gitter (CdI2)
Beispiel Lithiumoxid. Gehen wir vom Zinkblende-Gitter ZnS als einer 1 : 1 -Struktur aus (vgl. Abb. 7.7), dann können wir die noch leere Hälfte aller Tetraederlücken füllen und erhalten auf diesem Wege eine 1 : 2 - Struktur.
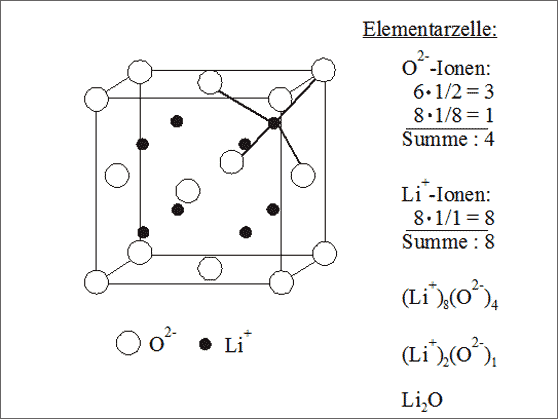
Abb. 7.14: Modellvorstellungen zum Lithiumoxid-Gitter (Li2O)
Die sehr kleinen Lithium-Ionen Li1+ lassen sich in Tetraederlücken setzen, die von Oxid-Ionen O2- in kubisch dichtester Packung gebildet werden (vgl. Abb. 7.14). Da die Anzahl der Tetraederlücken in einer dichtesten Kugelpackung doppelt so groß ist wie die der Packungskugeln, wird bei vollständiger Besetzung dieser Lücken eine 1 : 2 - Struktur erreicht: als Summensymbol erhalten wir (Li1+)2(O2-)1 bzw. Li2O. Auch das Auszählen der Elementarzelle führt zu diesem Symbol.
Wenn wir nur die Positionen und nicht die Größe der Ionen betrachten, dann ist diese Gitterstruktur mit der Struktur von Flußspat CaF2 baugleich (vgl. Abb. 7.10).
Beispiel Cristobalit. Der Weg zu einer 1 : 2 - Struktur ist auch möglich, indem Tetraeder-Koordinationen mit linearen Doppelhantel-Koordinationen kombiniert werden. Wenn wir von der Diamantstruktur ausgehen, dann ist jedes C-Atom mit vier weiteren C-Atomen tetraedrisch verknüpft (vgl. Band 3). Lediglich durch lineares Einschieben jeweils einer zweiten Teilchensorte zwischen die Positionen im Diamantgitter können wir die gewünschte 1 : 2 - Struktur erhalten.
Im konkreten Fall setzen wir auf die Gitterplätze des Diamantgitters Si4+-Ionen und linear zwischen jeweils zwei Silicium-Teilchen O2--Ionen (vgl. Abb. 7.15). Jedes Silicium-Ion ist dann tetraedrisch von vier Oxid-Ionen und jedes Oxid-Ion linear von zwei Silicium-Ionen umgeben. Bei völlig gleichmäßigem Gitterbau und einem Koordinationszahlverhältnis von 4 : 2 muß das Teilchenverhältnis 1 : 2 sein. Auch die Bilanz der Elementarzelle weist das aus (vgl. Abb. 7.15).
Dieses Gitter entspricht der Substanz Cristobalit, für das alle Beschreibungsweisen wie beim Diamant gelten (vgl. Band 3). Wir können zur Beschreibung von Sesseln mit 12 Teilchen im Ring ausgehen, wobei sich Si- und O-Teilchen abwechseln. Die Bindung Si-O-Si bleibt im Cristobalit immer linear - wir werden später andere Strukturen kennenlernen, bei denen ein Si-O-Si-Winkel vorliegt.

Abb. 7.15: Modellvorstellungen zum Cristobalit-Gitter (SiO2)
Cristobalit ist eine von sechs Modifikationen des SiO2, die von uns vorgestellt werden: Sie gehören alle in die Substanzfamilie des Quarzes. Zur Beschreibung des Cristobalit-Gitters haben wir hier Ionen verwendet. Wenn wir das Silicium zur rechten Seite des Periodensystems rechnen, dann müßten wir eigentlich Atome mit gerichteten Bindefähigkeiten zur Beschreibung heranziehen. Das trifft aber den Sachverhalt auch nicht exakt, weil das Silicium-Teilchen sich wie ein Zwitter zwischen Atom und Ion benehmen kann. Wir werden auf das Problem später zurückkommen.
![]()


