7.4.3 Zahlenverhältnis der Ionen von 1 : 3
Auf der Grundlage der speziellen Verknüpfungsweisen von zwei Ionenarten im Zahlenverhältnis von 1 : 2 können wir erreichen, daß durch gedankliches Entfernen von Ionen aus diesen Gittern neue Gitterstrukturen entstehen, deren eine Sorte in dreifacher Anzahl an der Gitterstruktur beteiligt ist, also ein Zahlenverhältnis von 1 : 3 resultiert. Dies soll an drei übersichtlichen Beispielen erläutert werden.
Wir erinnern uns, daß bei der Struktur des Cadmiumchlorids CdCl2 jede zweite Schicht von Oktaederlücken nicht mit Cadmium-Ionen gefüllt worden ist: bei vollständiger Füllung müßte wie beim Natriumchlorid einen Zahlenverhältnis der Ionen von 1 : 1 entstehen. Als eine Oktaederlückenschicht haben wir sämtliche Oktaederlücken zwischen zwei benachbarten dichtest gepackten Sechseckschichten der Chlorid-Ionen bezeichnet. Wir können nun gezielt aus jeder der im CdCl2-Gitter noch voll besetzten Oktaederlückenschicht so viele Ionen herausnehmen, daß wir im neuen Gitter das Ionenzahlenverhältnis von 1 : 3 erreichen.
Im Cadmiumchlorid ist der Besetzungsgrad der Oktaederlücken 1/2, eine Hälfte der Oktaederlücken ist also mit Cd2+-Ionen besetzt: in Sechsteln ausgedrückt sind das 3/6. Wollen wir den Besetzungsgrad 1/3 bzw. 2/6 erreichen, dann muß immer von drei Cd2+-Ionen eines entfernt werden. Die Schicht wird dadurch um 1/3 an Teilchen ärmer, sie wird nur noch zu zwei Drittel besetzt sein. Mit anderen Worten: Wenn jede Oktaederschicht zu besetzen wäre, würden wir in jeder Schicht ein Drittel der verfügbaren Plätze füllen. Ist wie im CdCl2-Gitter aber umschichtig jede zweite Oktaederlückenschicht ganz leer, dann müssen die besetzten Schichten jeweils zu zwei Drittel gefüllt sein.
Um ein günstiges System der Zweidrittelbesetzung herauszufinden, stellen wir eine Oktaederschicht, also zwei Schichten der Kugelpackung, anhand von regelmäßigen Sechsecken dar (vgl. (1) in Abb. 7.16): Jedes Sechseck stellt eine Oktaederlücke dar, die durch drei große Kugeln der unteren Kugelschicht und drei Kugeln der oberen Schicht gebildet wird.
Die Wabenstruktur kann man anhand von Sechseckketten beschreiben, bei denen die Sechsecke über eine gemeinsame Seite verknüpft sind. Diese Sechseckketten weisen jeweils in drei verschiedene Richtungen einen Winkel von 60° zueinander aus. Besetzen wir die Lücken, also symbolisch die Sechsecke, in jeder dieser drei Richtungen mit voll-voll-leer, dann wird immer eine leere Lücke von sechs vollen Lücken umgeben. Die leeren Lücken stellen für sich betrachtet ebenfalls ein Sechseckmuster dar. Die Teilchen in den Lücken bilden gemeinsam ein Sechseckwabennetz wie die C-Atome einer Graphitschicht (vgl. (1) in Abb. 7.16).
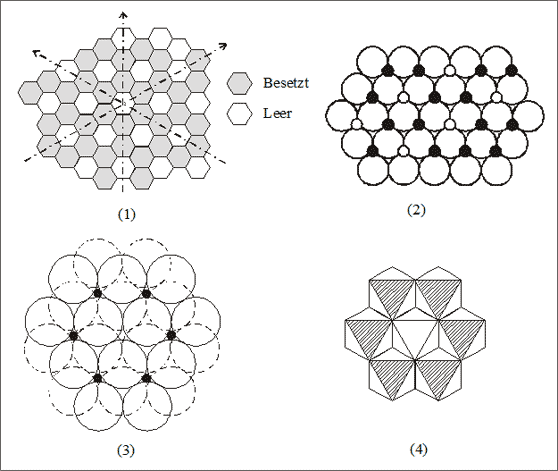
Abb. 7.16: Modellvorstellungen zur 2/3-Besetzung einer Oktaederlückenschicht
Es bleibt die Frage, wie sich die Teilchen gegenseitig berühren. Im Kochsalz NaCl werden die Na+-Ionen von je sechs Cl--Ionen berührt, und ein Cl--Ion ebenfalls von sechs Na+-Ionen: jeweils drei von unten und drei von oben, wie es unserer derzeitigen Betrachtung von auf einer Seite liegenden Oktaedern entspricht.
Im Cadmiumchlorid-Gitter (CdCl2) ist nur jede zweite Oktaederlückenschicht vollkommen besetzt: Die Cadmium-Ionen werden zwar wie im NaCl-Gitter von sechs Chlorid-Ionen berührt (drei von oben und drei von unten), die Chlorid-Ionen aber von nur drei Cadmium-Ionen: entweder drei von oben oder drei von unten.
Wenn wir unsere betrachteten, nur zu 2/3 gefüllten Oktaederschichten so stapeln, daß immer die vorhergehende und nachfolgende Oktaerderlückenschicht frei bleibt, dann wird jedes große Ion nur noch von zwei kleineren Lückenionen berührt (vgl. (2) und (3) in Abb. 7.16): entweder berühren zwei von oben oder zwei von unten. Jedes kleine Lückenion wird aber nach wie vor von sechs großen Ionen umgeben, denn sie sitzen alle jeweils in einem Oktaeder. So erhalten wir bei dieser Konstruktion die Koordinationszahlen 2 : 6, was unserem erwünschten Zahlenverhältnis der Gitterbausteine von 1 : 3 entspricht.
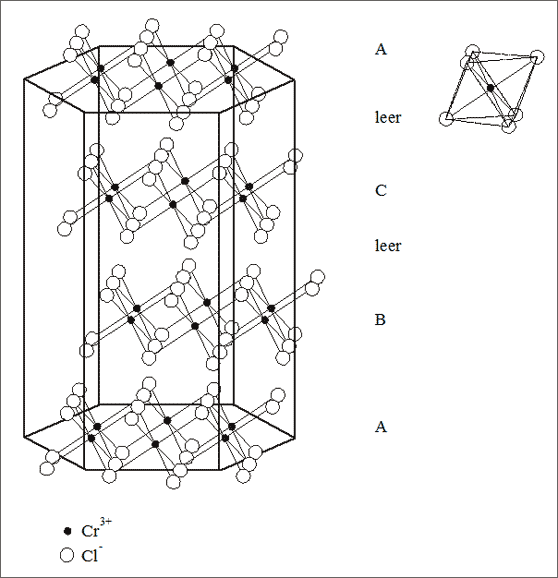
Abb. 7.17: Modellvorstellungen zum Chromtrichlorid-Gitter (CrCl3)
Beispiel Chromtrichlorid. Gehen wir von der Stapelung der Sechseckschichten für die kubisch dichteste Kugelpackung aus und besetzen die Oktaederlückenschichten abwechselnd entweder gar nicht oder anhand unseres 2/3-Musters, dann erhalten wir ein Gitter, das Cr3+-Ionen und Cl--Ionen miteinander bilden können (vgl. Abb. 7.17): die großen Chlorid-Ionen bilden die Kugelpackung, die kleinen Chrom-Ionen besetzen dabei die Oktaederlücken. Die Sechseckwabennetze der Cr3+-Ionen werden dabei so gestapelt, daß die vierte 2/3-Schicht mit der ersten wieder identisch ist. Die diesem Gitter entsprechende Substanz heißt Chromtrichlorid, das Summensymbol lautet (Cr3+)1(Cl1-)3 bzw. CrCl3.
Beispiel Bismutiodid. Stapeln wir unsere großen Ionen zur hexagonal dichtesten Kugelpackung und besetzen die Oktaederschichten abwechselnd entweder gar nicht oder anhand unseres 2/3-Musters, dann erhalten wir eine mögliche Konstruktion aus
Bi3+-Ionen und I--Ionen: die großen Iodid-Ionen bauen die hexagonale Kugelpackung, die Bismut-Ionen besetzen die Oktaederlücken. Die Substanz wird Bismutriodid genannt, das Summensymbol lautet (Bi3+)1(I1-)3 bzw. BiI3.
Beim Bismutiodid tritt die gleiche Schwierigkeit der Beschreibung der Teilchen auf wie beim Cristobalit SiO2. Wir haben zur Beschreibung des Kristalles von Bismutiodid als verknüpfte Teilchen Ionen gewählt, obwohl beide Teilchen rechts im Periodensystem eingeordnet sind. Die Beschreibung ist erlaubt, sie gibt jedoch nicht den vollen Sachverhalt der gerichteten oder ungerichteten Bindekräfte wieder. Wenn wir jedoch daran denken, daß immer zwei Wismut-Teilchen zu sechs Iod-Teilchen gehören, dann liegt es ebenso nahe, die Beschreibung anhand von BiCl3-Molekülen vorzunehmen. Das ist ebenfalls sinnvoll und möglich - wir werden darauf zurückkommen.
Beispiel Wolframtrioxid. Konstruktionen von Ionengittern im Zahlenverhältnis 1 : 3 sind auch möglich, wenn man aus der dichtesten Kugelpackung systematisch Teilchen entfernt und die restlichen Lücken besetzt. Ein diesbezügliches Beispiel ergibt die Verknüpfung von W6+-Ionen und O2--Ionen.
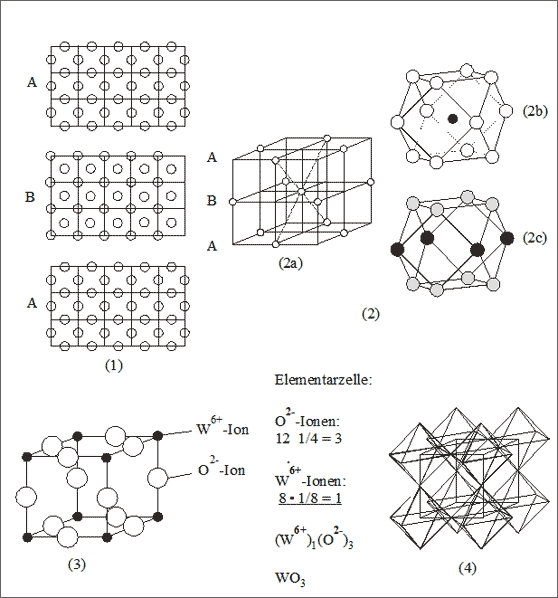
Abb. 7.18: Modellvorstellungen zum Wolframtrioxid-Gitter (WO3)
Betrachten wir eine kubisch dichteste Kugelpackung von Oxid-Ionen anhand der Quadratmaschenschichten mit der Abfolge A-B-A-B (vgl. (1) und (2) in Abb. 7.18). Nimmt man aus jeder zweiten Schicht die Hälfte der Teilchen gleichmäßig heraus, dann fehlt die Hälfte von der Hälfte, also ein Viertel aller Oxid-Ionen. Dies ist bei der kubisch dichtesten Kugelpackung mit der Beschreibung des Kubooktaeders darstellbar, bei dem das Zentralteilchen herausgenommen ist (vgl. (2b) und (2c) in Abb. 7.18). Das Entfernen des Viertels der Teilchen in dieser Art führt demnach zu einem luftigen Gerüst, das als System von gekoppelten leeren Kubooktaedern mit Oktaederlücken beschrieben werden kann. Die Entfernung des Teilchens aus jedem Kobooktaeder-Zentrum hat zur Folge, daß die sechs von den Quadratflächen ins Innere ragenden halben Oktaeder nichtmehr gebaut werden können. Also wird von ursprünglich vier Oktaedern der kubischen Elementarzelle nur mehr einer gebaut: er ist in unserer Darstellung durch acht Achtel an den Würfelecken angegeben. Es ist bemerkenswert, daß durch Reduzierung der Teilchen in der kubisch dichtesten Kugelpackung von beispielsweise 1000 auf 750 die Anzahl der Oktaederlücken von 1000 auf 250 erniedrigt wird. Sollen die 750 Teilchen durch Oxid-Ionen dargestellt werden und die 250 Oktaederlücken durch Wolfram-Ionen, dann resultiert das Zahlenverhältnis 3 : 1.
Die Darstellung des WO3-Gitters ist auch in anderen Beschreibungsweisen üblich. Wenn wir etwa den flächenzentrierten Würfel als Ausgangsgitter wählen, können wir – entsprechend der bereits diskutierten Entnahme der Hälfte der Oxid-Ionen aus jeder zweiten Quadratmaschenschicht – die Flächenzentren aus Grund- und Deckhälfte entfernen. Dann ist jeweils auf der Mitte der vier senkrechten Kanten ein Wolfram-Ion zu finden, das zu einem Viertel Oktaeder gehört. Häufig wird dieser Würfel auch gekippt dargestellt. Bei dieser Darstellung sind die Koordinationszahlen klar zu ermitteln: Jedes Wolfram-Ion ist oktaedrisch von sechs Oxid-Ionen und jedes Oxid-Ion linear von zwei Wolfram-Ionen umgeben. Das Koordinationsverhältnis ist 6:2 und damit das Teilchenverhältnis 3:1.
Verschieben wir den würfeligen Ausschnitt um eine halbe Kantenlänge nach oben oder unten, dann erhalten wir die kubooktaedrische Darstellung mit Besetzung der Kantenmitten durch Oxid-Ionen und Besetzung der Eckpositionen mit Wolfram-Ionen (vgl. (3) in Abb.7.18). An dieser würfelförmigen Darstellung kann auch die kubische Elementarzelle gut abgezählt werden: sie enthält 12∙1/4 = 3 Oxid-Ionen und 8 ∙ 1/8 = 1 Wolfram-Ion. Die Substanz heißt Wolframtrioxid, das entsprechende Summensymbol lautet (W6+)1(O2-)3 bzw. WO3.
Wird das WO3-Gitter nur anhand von Oktaedern mit besetztem Zentrum beschrieben, so erhält man eine regelmäßige kubische Oktaederanordnung (vgl. (4) in Abb. 7.18): jede Spitze eines Oktaeders ist gleichzeitig Spitze des benachbarten Oktaeders.
![]()


