7.4.1 Zahlenverhältnis der Kationen zu Anionen von 1 : 1
Sind die Ladungszahlen von Kationen und Anioinen gegenpolig gleich groß, so können gleiche Anzahlen beider Ionensorten in einem Kristall verknüpft werden. Die Bauweise wird dann entscheidend von den Ionengrößen des Anions und des Kations bestimmt, es werden je nach Radienverhältnis die Tetraederlücken, die Oktaederlücken oder die Hexaeder- bzw. Würfellücken gefüllt (vgl. Abb. 7.1).
Würfellücken. Die letztgenannte Bauweise ist uns bei der Messingsorte CuZn begegnet (Band 2). Ersetzt man die Cu-Atome durch Cl--Ionen und die Zn-Atome durch die relativ großen Cs+-Ionen, dann ist jedes Cäsium-Ion von 8 Chlorid-Ionen umgeben und jedes Chlorid-Ion von 8 Cäsium-Ionen. Die Koordinationszahlen lauten demnach 8 : 8. Die Elementarzelle enthält 1 Cs+-Ion und 1 Cl--Ion: daraus ergibt sich das Summensymbol CsCl (vgl. Abb. 7.4).
Es sei darauf hingewiesen, daß zwar die Koordinationszahl 8 mit der kubisch innenzentrierten Metallstruktur übereinstimmt, etwa mit der Struktur des Wolframs oder Natriums. Allerdings ist für die Strukturmodelle der reinen Metalle immer von gleichgroßen Kugeln auszugehen: es berühren sich zwar Zentrumskugel und Eckkugeln, die Eckkugeln untereinander aber nicht. Für die Cäsiumchlorid-Kugelpackung sind gemäß der unterschiedlichen Ionenradien unterschiedlich große Kugeln zu wählen: im Modell berühren die Eckkugeln nicht nur die kleinere Zentrumskugel, sondern sie berühren sich auch untereinander (vgl. Abb. 7.4).
Der Name der Substanz ist Cäsiumchlorid, es bildet farblose, glasartig durchsichtige würfelförmige Kristalle: sie sind von denen der Kochsalzkristalle mit dem Auge allein nicht zu unterscheiden.
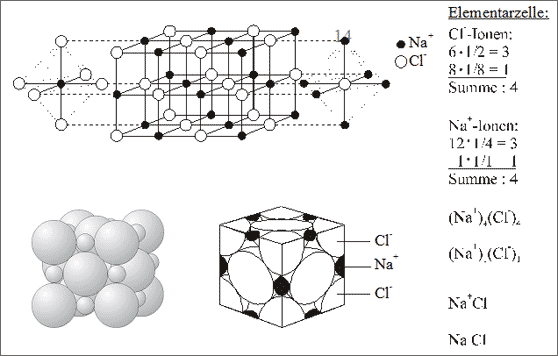
Abb. 7.4: Modellvorstellungen für die Struktur des CsCl-Ionengitters
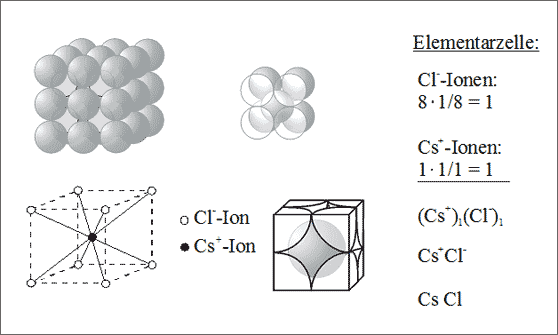
Abb. 7.5: Modellvorstellungen für die Struktur des NaCl-Ionengitters
Oktaederlücken. Diese Bauweise ist uns - wie bereits bemerkt - bei der Substanz Molybdännitrid (MoN) begegnet (siehe Band 2). Ersetzen wir die Mo-Atome der kubisch dichtesten Packung durch Cl--Ionen und die N-Atome in allen Oktaederlücken durch Na+-Ionen, dann ist jedes Natrium-Ion oktaedrisch von sechs Chlorid-Ionen und jedes Chlorid-Ion oktaedrisch von sechs Natrium-Ionen umgeben (vgl. Abb. 7.5). Die Koordinationszahlen sind 6 : 6, die Elementarzelle enthält vier Na+-Ionen und vier Cl--Ionen, daraus ergibt sich das Summensymbol:
(Na+)4(Cl-)4 bzw. Na4Cl4 bzw. NaCl.
Die Substanz heißt allgemein Kochsalz oder Natriumchlorid und ist die bekannteste Ionen-verbindung. Sie bildet schöne farblose, würfelförmige Kristalle. In Steinsalzlagern gefundene - oftmals sehr große - Steinsalzkristalle können auch blau oder rötlich gefärbt sein: solche Färbungen gehen auf Verunreinigungen durch andere Substanzen zurück.
Das Gegenstück zur Kochsalzstruktur, ausgehend von einer hexagonal dichtesten Packung, ist die Struktur des Minerals Rotnickelkies. Hier bilden Arsen-Teilchen eine hexagonal dichteste Kugelpackung und Nickel-Teilchen besetzen alle oktaedrischen Lücken. Somit sind alle Nickel-Teilchen oktaedrisch von Arsen-Teilchen umgeben, die Arsenteilchen aber trigonal prismatisch von den Nickelteilchen (vgl. Abb. 7.6). Die Koordinationszahlen sind 6 : 6 .
Das Zahlenverhältnis der Arsen- und Nickel-Teilchen ist 1 : 1, folglich das Summensymbol NiAs. Beide Teilchensorten sollten wir als Ionen beschreiben können, was allerdings nicht so ohne weiteres möglich ist. Nehmen wir an, das Arsen-Teilchen wäre ein As3--Ion, dann müßte das Nickel-Ion eine Normladung von 3+ tragen. Das läßt sich experimentell aber nicht nachweisen: Wenn man das Nickel aus dem Rotnickelkies herauslöst, erhält man in der Lösung Ni2+-Ionen. Zu diesen Nickel-Ionen würden aber As2--Ionen als Anionen gehören, die wir nicht kennen. Insofern wird die Beschreibung schwierig. Wir werden dem Sachverhalt erst dann gerecht, wenn wir annehmen, daß sich die As-Atome gleichzeitig als As2--Ion und als Metall-Atom mit ungerichteten Bindungsanteilen verhalten. Später werden wir ausführlicher auf diese Fragestellung eingehen.
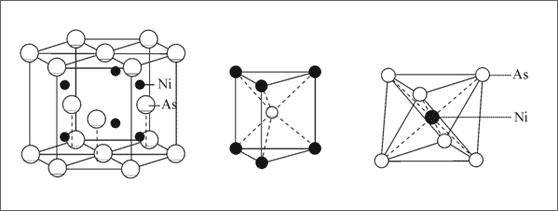
Abb. 7.6: Modellvorstellungen für die Struktur des NiAs-Ionengitters
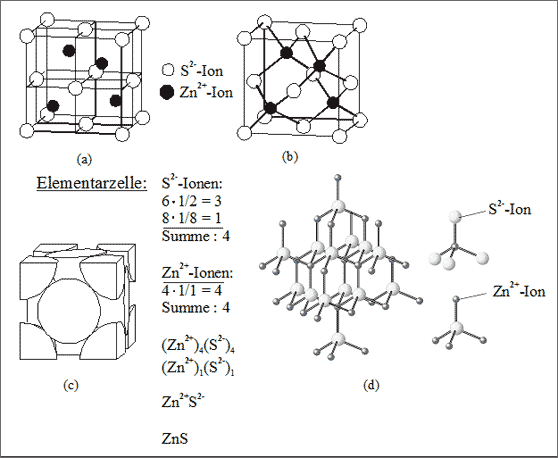
Abb. 7.7: Modellvorstellungen für die Struktur des Zinkblende-Ionengitters (ZnS)
Tetraederlücken. Die Besetzung von Tetraederlücken kennen wir bereits von der TiH-Struktur: eine kubisch dichteste Packung von Ti-Atomen, bei der jede zweite Tetraederlücke mit einem H-Atom besetzt ist. Ersetzen wir die Ti-Atome durch eine kubisch dichteste Kugelpackung von S2--Ionen und die H-Atome durch Zn2+-Ionen, dann erhalten wir die Struktur des Minerals Zinkblende: jedes Zn2+-Ion ist tetraedrisch von vier S2--Ionen umgeben und umgekehrt, die Koordinationszahlen lauten 4 : 4 (vgl. (a) und (b) in Abb. 7.7). Die Elementarzelle enthält vier Zn2+-Ionen und vier S2--Ionen (c), daraus ergibt sich das Summensymbol (Zn2+)4(S2-)4 bzw. (Zn2+)1(S2-)1 bzw. ZnS.
Im Übrigen sind die Positionen der Zink- und Sulfid-Ionen in der Zinkblende identisch mit den Positionen der C-Atome im Diamantgitter (vgl. (d) in Abb. 7.7; siehe auch entsprechende Ausführungen im Band 3).
Reine Zinkblendekristalle sind farblos und besitzen häufig die Gestalt eines Oktaeders. Durch Mischkristallbildung mit Ionen anderer Sorten können sie jedoch jede dunklere Farbe bis hin zu schwarz annehmen.
Das Gegenstück zur Zinkblende ist mit der hexagonal dichtesten Kugelpackung als Grundbaumuster der Wurtzit. Die großen S2--Ionen bilden die hexagonal dichteste Packung und die kleinen Zn2+-Ionen besetzen jede zweite tetraedrische Lücke.
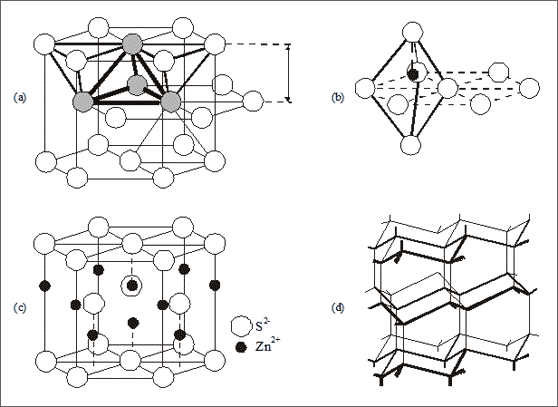
Abb. 7.8: Modellvorstellungen für die Struktur des Wurtzit-Ionengitters (ZnS)
Je zwei lückenbildende Tetraeder besitzen parallel zu den dichtest gepackten Flächen eine gemeinsame Grundfläche, wobei ein Tetraeder mit der Spitze nach oben und einer mit der Spitze nach unten zeigt (vgl. (a) und (b) in Abb. 7.8). Im Ionengitter des Wurtzitkristalls sind nur die Tetraeder mit der Spitze in eine Richtung - beispielsweise nach oben - mit Zink-Ionen besetzt (vgl. (c) in 7.8). Alle Zink-Ionen sind so tetraedrisch von Sulfid-Ionen umgeben und alle Sulfid-Ionen ebenfalls tetraedrisch von Zink-Ionen. Die Koordinationszahlen sind 4 : 4 , das Summensymbol ist wie bei der Zinkblende (Zn2+)1(S2-)1 bzw. ZnS. Insofern sind Zinkblende und Wurtzit zwei Modifikationen des Zinksulfids.
Um wiederum den Vergleich mit dem Diamantgitter aufzunehmen: Zink- und Sulfid-Ionen besetzen im Wurtzit die gleichen Plätze wie die C-Atome in der „Hindurchlangform“ des Diamantgitters (vgl. (d) in Abb. 7.8; siehe auch entsprechende Ausführungen in Band 3).
![]()


