6.4 Spezielle Molekülstrukturen
Das SO3-Molekül ist beschreibbar als exakt ebenes, gleichseitiges Dreieck, das CH4-Molekül als exakter Tetraeder. Viele kleinere Moleküle, die zwar nicht genau diese Bauformen besitzen, lassen sich ebenso anhand von Dreiecken und Tetraedern gut beschreiben. Dazu zählen u.a. Kombinationen vieler Nichtmetall-Atome mit O-Atomen oder OH-Gruppen.
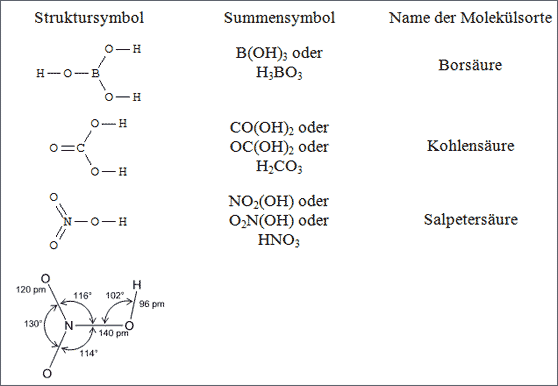
Abb. 6.16: Symbole für einige Dreiecksmoleküle, Zentralatome B, C und N
Die Atome der 2. Periode B, C und N können nun O-Atome und OH-Gruppen so um sich in einer Ebene knüpfen, daß zusammen mit dem Atom im Zentrum Dreiecke resultieren. Wie viele Ecken dieser ebenen Dreiecke etwa durch O-Atome oder OH-Gruppen besetzt sind, das hängt von der Anzahl der Bindefähigkeiten des Zentral-Atoms ab. Je mehr Bindefähigkeiten das Zentralatom betätigt, desto mehr O-Atome werden mit einer Doppelbindung gebunden und damit desto weniger OH-Gruppen durch eine Einfachbindung (vgl. Abb. 6.16):
Das B-Atom kann direkt drei OH-Gruppen knüpfen,
das C-Atom verknüpft ein O-Atom und zwei OH-Gruppen,
das N-Atom zwei O-Atome und eine OH-Gruppe.
Die O-Atome sind teilweise mit Doppelbindungen und teilweise mit Einfachbindungen geknüpft, das entspricht kürzeren und längeren Bindungsabständen. Insofern ist eigentlich nur das Borsäure-Molekül mit einem B-O Abstand von 136 pm exakt mit einem regelmäßigen Dreieck beschreibbar. Das Kohlensäure-Molekül ist bereits mit einer Doppelbindung nicht mehr exakt regelmäßig aufgebaut, das Salpetersäure-Molekül mit zwei Doppelbindungen ebenfalls nicht: Die N=O-Abstände betragen 120 pm (Doppelbindung) und der N-O-Abstand beträgt 140 pm (Einfachbindung). Meßdaten, die im Laboratorium am Salpetersäure-Molekül gemessen worden sind, zeigt Abb. 6.16.
Die Atome der 3. Periode Si, P, S und Cl können sich tetraedrisch mit O-Atomen oder OH-Gruppen umgeben. Auch hier gilt: Je mehr Bindefähigkeiten das Zentralatom betätigt, desto mehr O-Atome mit Doppelbindungen werden an das Zentralatom gebunden und dementsprechend weniger OH-Gruppen (vgl. Abb. 6.17):
Das Si-Atom kann direkt vier OH-Gruppen binden, das P-Atom ein O-Atom und drei OH-Gruppen, das S-Atom zwei O-Atome und zwei OH-Gruppen, das Cl-Atom drei O-Atome und eine OH-Gruppe.
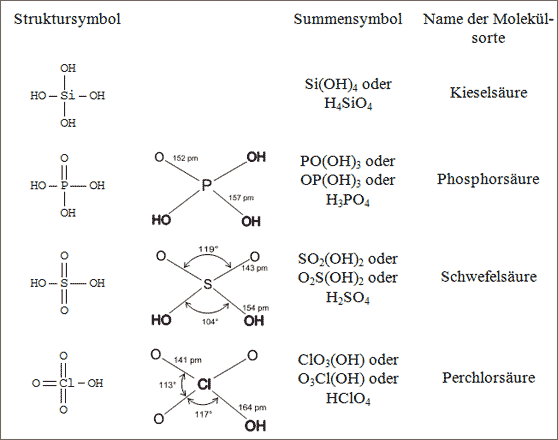
Abb. 6.17: Symbole für einige Tetraedermoleküle, Zentralatome Si, P, S und Cl
Die Moleküle enthalten wiederum wie die vorher beschriebenen dreiecksförmigen Moleküle Doppelbindungen und Einfachbindungen, so daß die Abstände vom Zentralatom zu den jeweiligen O-Atomen verschieden sind. Eine Ausnahme bildet das Kieselsäure-Molekül Si(OH)4: die O-Atome formen um das Si-Atom herum einen exakten Tetraeder. Die anderen Moleküle lassen sich durch die verschiedenen Atomabstände als verzerrte Tetraeder beschreiben (vgl. Abb. 6.17).
Sowohl die "Dreiecksäuren" als auch die "Tetraedersäuren" haben als Gemeinsamkeit, daß das Zentralatom im Zustand der maximalen Bindefähigkeit vorliegt: die Bindefähigkeiten binden so viele O-Atome als möglich. Da nicht alle Bindefähigkeiten allein durch O-Atome abzusättigen sind, wird der verbleibende Rest der Bindefähigkeiten am Zentralatom mit OH-Gruppen versehen.
Die Frage, ob sich ein Atom mit drei Bindungspartnern dreieckig planar oder mit vier Bindungspartnern tetraedrisch umgibt, ist in unserem Rahmen mit der Atomgröße zu beantworten. Die kleinsten Atome, die eine Hauptgruppe anführen, "passen" vom Raumbedarf her in die Lücke zwischen drei planar angeordnete O-Atome. Die in der Hauptgruppe folgenden Atome werden größer und vermögen die tetraedische Lücke von vier O-Atomen zu füllen.
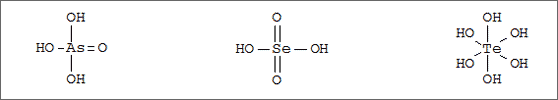
Abb. 6.18: Molekülstrukturen mit Tetraeder- und Oktaederform
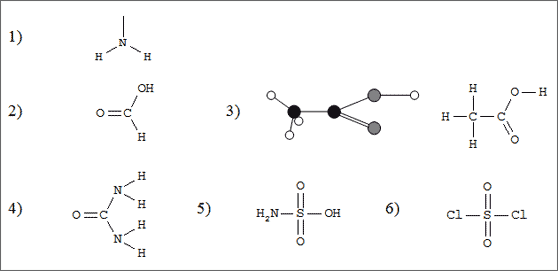
Abb. 6.19: Neue Molekülstrukturen durch Substitution
In Analogie zu der im vorherigen Abschnitt beschriebenen Bauweise existiert zum tetraedrischen Phophorsäure-Molekül PO(OH)3 ein ebenfalls tetraedrisch gebautes Arsensäure-Molekül AsO(OH)3, und zum tetraedrischen Schwefelsäure-Molekül SO2(OH)2 ein tetraedrisches Selensäure-Molekül SeO2(OH)2 (vgl. Abb. 6.18). Das dem Se-Atom in der Hauptgruppe folgende Te-Atom ist aber bereits so groß, daß es in einen Oktaeder paßt, den sechs O-Atome um das Te-Atom bilden können. Verknüpfen wir sechs OH-Gruppen in Form eines Oktaeders um das Te-Atom, dann erhalten wir ein Tellursäure-Molekül mit dem Summensymbol Te(OH)6 oder H6TeO6 (vgl. Abb. 6.18).
Substitution an Molekülen mit Dreiecks- und Tetraederform. Alle die in diesem Abschnitt genannten Moleküle lassen sich durch Abtrennen von Atomen oder Atomgruppen und Ersatz durch andere Atome oder Atomgruppen in neue Moleküle und oftmals auch. andere Molekülstrukturen umwandeln.
Wir haben bereits als Atomgruppen die niedrige Pyramide -CH3 und die Hantel -OH kennengelernt, die oftmals leicht an ein Restmolekül angekoppelt werden können. Wenn man der niedrigen Pyramide des NH3-Moleküls ein H-Atom entreißt, dann bleibt als Rest ein gewinkelte Atomgruppe: -NH2 (vgl.(1) in Abb. 6.19). Diese Atomgruppe kann man ebenfalls vielseitig an andere Moleküle anknüpfen, denen ein Atom oder eine Atomgruppe abgetrennt worden ist. Einige Beispiele sollen dies zeigen.
Gehen wir von einem Kohlensäure-Molekül mit Dreiecksstruktur aus. Entreißen wir diesem Molekül eine OH-Gruppe und ersetzen sie durch ein H-Atom, dann bleibt die Dreieckstruktur erhalten (vgl. (2) in Abb. 6.10). Das entstandene Moleküls ist das Ameisensäure-Molekül, das Summensymbol lautet CH2O2 oder HCOOH. Man sagt auch, die OH-Gruppe des Kohlensäure-Moleküls sei durch ein H-Atom substituiert worden.
Substituieren wir in diesem Ameisensäure-Molekül das am C-Atom sitzende H-Atom durch eine CH3-Gruppe, dann können wir uns das Essigsäure-Molekül als Dreieck vorstellen, das nun an der einen Ecke zusammen mit dem Zentral-Atom des Dreiecks einen Tetraeder bildet (3). Wie wir das neue Molekül auch beschreiben, das Summensymbol lautet C2H4O2 oder CH3COOH.
Gehen wir erneut von dem Kohlensäure-Molekül aus und trennen beide OH-Gruppen ab: Es bleibt lediglich als Rest ein C-Atom, das mit einem O-Atom über eine Doppelbindung verknüpft ist und zwei freie Bindefrähigkeiten anbietet. Knüpfen wir jeweils eine NH2-Gruppe an, dann erhalten wir ein Molekül, bei dem an das zentrale C-Atom das O-Atom mit Doppelbindung und zwei N-Atome mit Einfachbindungen angekoppelt sind. Die Dreieckstruktur des ehemaligen Kohlensäure-Moleküls ist dabei erhalten geblieben. Die N-Atome bilden aber mit den beiden mitgebrachten H-Atomen und dem neu angekoppelten C-Atom nach wie vor flache Pyramiden. (vgl. (4) in Abb. 6.19). Das so gewonnene neue Molekül, das wir formal vom Kohlensäure-Molekül abgeleitet haben, heißt Harnstoff-Molekül, das nichtssagende Summensymbol lautet CON2H4. Wer allerdings das Molekül kennt, wird es besser anhand des Halbstruktursymbols (NH2)2CO wiedererkennen.
Wählen wir uns als Beispiel zur Substitution an einem tetraederförmigen Molekül das H2SO4-Molekül. Wir können eine OH-Gruppe entreißen und dafür die NH2-Gruppe anknüpfen (vgl. (5) in Abb. 6.19): Das neue Molekül besitzt den Namen Amidosulfonsäure mit dem wiederum nichtssagenden Summensymbol H3SO3N. Teilstruktursymbole NH2SO3H oder NH2SO2OH werden in der Praxis bevorzugt.
Entfernen wir vom Schwefelsäure-Molekül beide OH-Gruppen und ersetzen diese durch zwei Cl-Atome, so erhalten wir das tetraedrische Molekül mit dem Namen Sulfurylchlorid (vgl. (6) in Abb. 6.19). Das Summensymbol ist SO2Cl2.
Vom Adamantan-Molekül abgeleitete Strukturen. Wir haben bereits das hochsymmetrische Adamantan-Molekül C10H16 kennengelernt (vgl. Abb. 6.7). Die Anordnung der 10 C-Atome wurde durch vier ineinander verschränkte C6-Sessel beschrieben: ein Sessel bildet die Basis und davon senkrecht ausgehend formen drei weitere Sessel die Molekülstruktur (vgl. (1) in Abb. 6.20). Diese Struktur soll nun übertragen werden auf die Struktur von P4O6- und P4O10-Molekülen, die die Phosphoroxide aufbauen. Sie sind bei Zimmertemperatur feste Kristallpulver von weißer Farbe.
Gehen wir zunächst von den P-Atomen mit minimaler Bindefähigkeit drei aus und verknüpfen abwechselnd P- und O-Atome zu einem P3O3-Sessel. Dabei können die "auf"-Atome die P-Atome und die "ab"-Atome die O-Atome sein (vgl.(1) in Abb. 6.20). Die drei "auf"-P-Atome richten ihre dritte Bindefähigkeit senkrecht zur Sesselfläche nach oben. Daran knüpfen sich nun die O-Atome, die wiederum alle drei vom gleichen P-Atom zusammengebunden werden. Auf diese Weise haben wir senkrecht zur ursprünglichen Sesselfläche drei weitere Sessel gebaut und das Baugerüst des Adamantans erhalten. Die P-Atome stehen zueinander in der Position eines Tetraeders, dessen sechs Kanten von O-Atomen überbrückt werden. Die sechs O-Atome bilden in ihrer Lage zueinander einen Oktaeder. Wenn wir uns vergegenwärtigen, daß wir mit dieser Struktur einen kleinen Ausschnitt aus dem Diamantgitter gebaut haben, dann finden wir diesen Ausschnitt wieder, wenn wir dem flächenzentrierten Würfel die acht Ecken entfernen (vgl. (4) in Abb. 6.7) . Die sechs O-Atome bilden dann die sechs Flächenzentren und die vier P-Atome die Positionen der abwechselnd besetzten Tetraederlücken.
Liest man das Summensymbol P4O6, muß man die Adamantanstruktur dazu gespeichert haben. In früheren Zeiten war die Struktur dieses Moleküls nicht klar. Die Fachleute glaubten, es sei aus zwei P-Atomen und drei O-Atomen zusammengesetzt, weil dies beim verwandten N so ist. Deshalb haben sie das Molekül mit dem Summensymbol P2O3 belegt. Traditionsgemäß wird auch heute noch anstelle von P4O6 das alte Symbol P2O3 in Büchern und auf Chemikalienflaschen als Information verwendet. Jeder Fachmann weiß das und stört sich nicht daran.
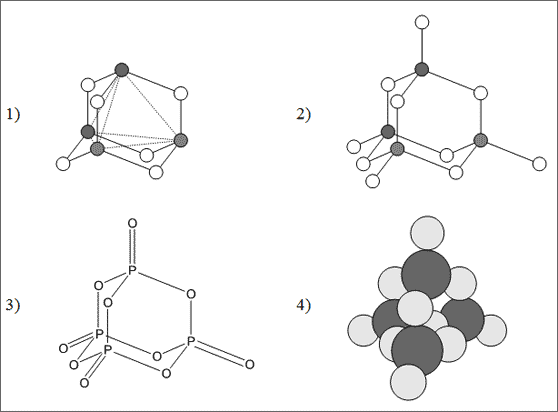
Abb. 6.20: Modelle für die Strukturen der P4O6- und P4O10-Moleküle
In vielen anderen Fällen ist die Situation ähnlich. Es stört sich auch niemand daran, daß man einen Bleistift im Bürogeschäft verlangt und einen Graphitstift ausgehändigt bekommt. Der Fachmann weiß Bescheid, für den Nichtfachmann ist es uninteressant und in der Praxis funktioniert die Information.
Wenn sich die P-Atome im Zustand der maximalen Bindefähigkeit befinden, also fünf Normbindefähigkeiten betätigen, bauen P- und O-Atome zunächst das Adamantangerüst des P4O6-Moleküls. Damit bleiben an jedem P-Atom noch zwei Bindefähigkeiten offen, an die mit einer Doppelbindung zusätzlich je ein O-Atom gebunden werden kann. Diese zusätzlichen O-Atome werden so an die P-Atome geknüpft, daß jeweils alle vier O-Atome ein P-Atom tetraedrisch umgeben (vgl. (2), (3) und (4) in Abb. 6.20). Wir können das gesamte Molekül auch so beschreiben, daß drei PO4-Tetraeder so zu einem Ring zusammengebaut werden, daß zwei Tetraeder immer eine Spitze gemeinsam besitzen. Auf die senkrecht nach oben gerichteten drei Tetraederspitzen wird ein vierter PO4-Tetraeder gesetzt: Es resultiert das Molekül P4O10.
Die Positionen der vier zusätzlichen O-Atome zueinander ergeben wieder einen Tetraeder. Sie bilden gleichzeitig vier der acht Würfelecken des flächenzentrierten Würfelausschnitts des Diamantgitters. Die sechs Kanten des tetraedrischen Käfigmoleküls bilden die Flächendiagonalen der sechs Würfelflächen. Die P- und O-Atome sind demnach ebenso angeordnet wie C-Atome in einem Diamantgitter, lediglich in einem begrenzten Ausschnitt.
Für das Summensymbol P4O10 gilt für den praktischen Gebrauch das gleiche wie für das Summensymbol P4O6: Aus Gründen der Tradition wird anstelle von P4O10 oftmals das Symbol P2O5 verwendet und die Substanz Phoshorpentoxid genannt.

Abb. 6.21: Beispiele für Konstitutionsisomerie
![]()


