6.2.5 Atome der 4. Hauptgruppe
Die 4. Hauptgruppe besitzt wie die 5. Hauptgruppe keinen besonderen Namen und wird nach der ersten Teilchensorte Kohlenstoffgruppe genannt. Dem Kohlenstoff folgen die Elemente Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Die Bindekräfte dieser Atome unterscheiden sich noch stärker als bei der 5. Hauptgruppe: Das C-Atom als Anführer der Gruppe besitzt vier gerichtete Normbindefähigkeiten, während Pb-Atome völlig ungerichtete, metallische Bindefähigkeiten besitzen und ein kubisch flächenzentriertes Metallgitter bauen. Wie dieser Übergang innerhalb einer Hauptgruppe zu verstehen ist, werden wir später ausführlich erläutern. Zunächst interessieren uns die Atomsorten C, Si und Ge mit ihren gerichteten Bindefähigkeiten, wobei wir in diesem Zusammenhang auch noch dem Sn-Atom mit aller Vorsicht gerichtete Bindefähigkeiten zuschreiben dürfen.
Die vier Normbindefähigkeiten ordnen sich in der Weise an einem Atom an, daß der Winkel zu jeder benachbarten Bindefähigkeit gleich groß ist: das ist der uns bereits bekannte Winkel von 109,5° (vgl. (1) in Abb. 6.4). Wenn wir alle vier Bindefähigkeiten modellmäßig gleich lang machen, ergeben die vier Endpunkte die vier Spitzen eines gedachten Tetraeders. Der Winkel “Spitze-Mittelpunkt-Spitze” von 109,5 o wird als Tetraederwinkel bezeichnet. Während es mit drei Bindefähigkeiten nur möglich ist, zweidimensional zu bauen, kann man mit diesen vier tetraedrisch angeordneten Bindefähigkeiten die Teilchen dreidimensional zu räumlichen Gittern verknüpfen.
Räumliche Kristallgitter einer einzigen Atomart, die sich ausschließlich durch gerichtete Bindefähigkeiten verknüpfen, können nur mit Atomen der 4. Hauptgruppe erhalten werden.
Obwohl man eine große Vielfalt von Konstruktionsmöglichkeiten mit Atomen, die vier Normbindefähigkeiten betätigen, erwartet, sind nur zwei Grundkonstruktionen an echten Substanzen gefunden worden: Eine Struktur, die zu Flächen führt und eine, die ein räumliches Gitter ergibt. Mit C-Atomen lassen sich beide Konstruktionen verwirklichen, mit Atomen des Siliciums und Germaniums nur die räumliche Struktur. Im Folgenden werden wir beide Konstruktionen anhand der C-Atome beschreiben und erläutern. Die flächenhafte Anordnung der C-Atome führt zur Substanz Graphit und die räumliche zur Substanz Diamant. Graphit und Diamant sind demnach zwei Modifikationen des Kohlenstoffs.
Besonders wichtig in diesem Zusammenhang sind die Möglichkeiten der Bündelung von Normbindefähigkeiten an den C-, Si- und Ge-Atomen. Die Meßergebnisse aus dem Labor haben erbracht, daß sich die vier Normbindefähigkeiten des C-Atoms in allen möglichen Varianten gut bündeln lassen, die Normbindefähigkeiten der Si- und Ge-Atome in der Regel aber nicht. Eine Doppel-, Dreifachbindung oder 1,5-Bindung ist zwischen den C-Atomen sehr häufig anzutreffen, zwischen Si-Atomen oder zwischen Ge-Atomen aber praktisch nicht.
Eine Bündelung der vier Normbindefähigkeiten zu drei Bindungsrichtungen ist am C-Atom gängig und leicht zu erreichen. Als Modell dieser Bündelung stellen wir uns wieder eine Mädchenfrisur vor, diesmal aber mit vier Zöpfen. Ein Zopf davon wird aufgelöst, die Haare dieses Zopfes werden anschließend gleichmäßig auf die anderen drei Zöpfe verteilt und eingeflochten. Die Haare der ursprünglich vier Normzöpfe sind somit auf drei Zöpfe aufgeteilt, wobei nun jeder der drei Zöpfe als 1,33 Normzöpfe beschrieben werden kann: Die Summe der Haare bleibt gleich.
In dieser Art können wir uns die Bündelung und Umverteilung der Normbindekräfte am C-Atom vorstellen. Die vier Normbindefähigkeiten werden zu drei Bindekräften, die wir mit je 1,33 Normbindefähigkeiten beschreiben, umfunktioniert. Wie Messungen im Labor ergeben haben, liegen diese drei Bindungen zu je 1,33 Normbindefähigkeiten in einer Ebene und bilden gegeneinander einen Winkel von 120° (vgl. (2) in Abb. 6.4).
Mit diesen Überlegungen kommen wir auf unsere beiden Strukturen zurück, die dem Graphit und dem Diamanten zugrunde liegen.
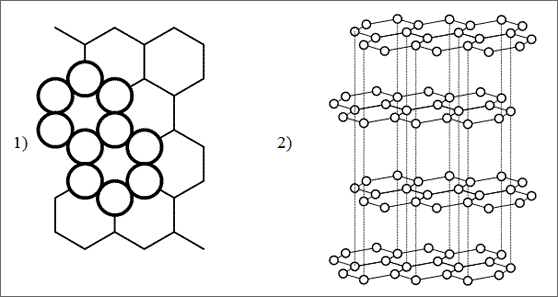
Abb. 6.5: Ebene Flächen von C-Atomen in der Graphitstruktur
Graphitstruktur. C-Atome, deren drei Bindefähigkeiten zu drei 1,33-Norm-bindungen und Winkeln zueinander von 120° umfunktioniert sind, lassen sich mühelos zu regelmäßigen Sechseckringen zusammensetzen. Dabei beträgt der C - C Bindungsabstand 142 pm: er liegt zwischen dem Abstand für eine C - C Einfachbindung (154 pm) und einer C = C Doppelbindung (133 pm).
Beliebig viele solcher regelmäßiger Sechseckringe verknüpfen sich zu einer ebenen Struktur, die an ein Bienenwabennetz erinnert (vgl. (1) in Abb. 6.5). Die Schichtung dieser “Wabennetze” nach einem bestimmten Muster führt dann zu den jeweiligen Graphitarten. Die übliche Graphitstruktur ist dadurch gekennzeichnet, daß die ebenen C-Schichten versetzt aufeinanderliegen (vgl. (2) in Abb. 6.5).
Diamantstruktur. Die vorher beschriebenen Sechseckringe mit dem Bindungsgrad 1,33 sind eben gebaut, die Sechseckringe mit dem Bindungsgrad 1,0 der Einfachbindung gewinkelt (vgl. (7) in Abb. 6.3). Die C-Atome können mit ihren gewinkelten Normbindungen mühelos Sechserringe bauen, sowohl in Sessel als auch in Wannenform (vgl. (5) und (6) in Abb.6.3). Zum Bau der Diamantstruktur werden allerdings keine Sechseckringe in Wannenform verwendet, sondern ausschließlich solche in Sesselform.
Die Sessel der 4. Hauptgruppe unterscheiden sich von den Sesseln der 5. Hauptgruppe durch zusätzliche Bindefähigkeiten. Zur Ringbildung werden je Atom zwei Bindefähigkeiten beansprucht, so daß bei Atomen der 5. Hauptgruppe je Atom nur eine weitere Bindefähigkeit zur Verfügung steht, während bei Atomen der 4. Hauptgruppe je Atom zwei weitere Bindefähigkeiten vorhanden sind. Beschreiben wir den Sessel in der Atomabfolge einfach mit “auf/ab”, dann liegen die drei “Ab-Atome” in einer Ebene, ein klein wenig höher in einer Ebene die “Auf-Atome”. In dieser Lage zeigt je eine freie Bindefähigkeit der “Auf-Atome” genau senkrecht nach oben, und je eine freie Bindefähigkeit der “Ab-Atome” senkrecht nach unten: pro Ring zeigen also drei Bindefähigkeiten senkrecht nach oben, drei senkrecht nach unten (vgl. (1) in Abb. 6.6)
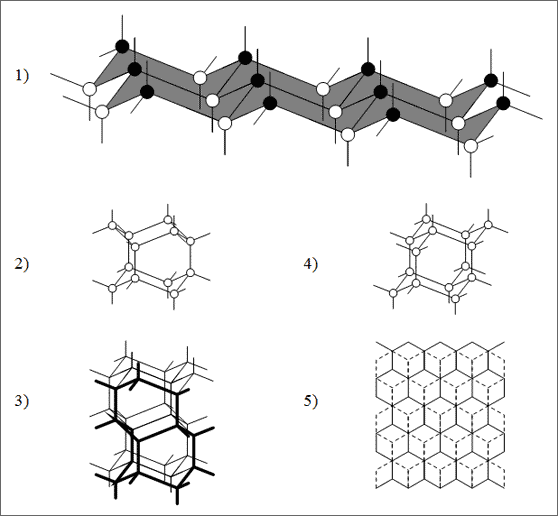
Abb. 6.6: Gewinkelte Flächen von C-Atomen und deren Stapelmöglichkeiten
Stapelt man diese gewellten Wabenflächen übereinander, kann man die Bindefähigkeiten der “Auf-Atome” der unteren Schicht mit den Bindefähigkeiten der “Ab-Atome” der oberen Schicht genau zur Deckung bringen und koppeln. Dabei gibt es aber zwei Möglichkeiten, die jeweils zu einer anderen Struktur und damit zu einer anderen Substanz führen.
1. Stapelmöglichkeit: Die Schichten werden so übereinandergelegt und dann gekoppelt, daß alle Sesselringe genau senkrecht aufeinander liegen. Dabei erhält man senkrecht zur Stapelrichtung Sechseckkäfige, von Sesseln gebildet, die sich röhrenartig ausbilden und fortsetzen. Im Modell kann man durch diese Röhren mit der Hand senkrecht zu den Sesseln hindurchlangen. Wir nennen diese Struktur deshalb “Hindurchlangform” (vgl. (2) und (3) in Abb. 6.6). Betrachtet man bei dieser Hindurchlangform die Ringe, die beim Stapeln neu entstanden sind, so findet man Sechserringe in Wannenform. Diese Struktur, die solche wannenförmigen Ringe enthält, ist nicht die des normalen Diamanten und wird von C-Atomen nur sehr selten unter extremen Bedingungen ausgebildet. Sie wird uns später aber bei anderen Teilchensorten begegnen.
2. Stapelmöglichkeit: Die gewellten Wabenschichten aus Sesseln werden so übereinandergelegt, daß über der Mitte eines Sechsrings ein Atom der nächsten Schicht trifft. Dann werden entsprechend der ersten Stapelmöglichkeit die Bindefähigkeiten der “Ab-Atome” mit den Bindefähigkeiten der “Auf-Atome” gekoppelt.
Es entsteht eine räumliche Konstruktion, bei der man allerdings nicht mehr senkrecht durch die Sessel “hindurchlangen” kann. Wir bezeichnen diese Bauweise als “Nichthindurchlangform”. Bei diesem Stapelprozeß sind auch die senkrecht entstehenden Sechsringe solche mit Sesselform (vgl. (4) und (5) in Abb. 6.6). Diese Struktur besitzt der Diamant. Am Modell kann man erkennen, daß die Bauweise sehr “luftig” ist: sie enthält viele Hohlräume, die Packungsdichte ist nur 34%. Wer einen Diamant kauft, erwirbt für sein teures Geld nahezu 2/3 Hohlräume!
Die Diamantstruktur übertrifft in ihrer Symmetrie viele andere Strukturen und ist deshalb in ihrer Wichtigkeit ranggleich neben dichteste Kugelpackungen einzuordnen. Insofern ist es notwendig, die Diamantstruktur aus vielen Blickwinkeln heraus wiederzuerkennen: sie soll daher dementsprechend in sieben verschiedenen Beschreibungsweisen vorgeführt werden.
Diamantstruktur, 1. Beschreibungsweise. Es soll hier die Bauanleitung anhand der Sesselflächen gelten, die als 2. Stapelmöglichkeit bereits beschrieben worden ist (vgl. (4) und (5) in Abb. 6.6 und (1) in Abb. 6.7).
2. Beschreibungsweise. Wir lösen aus dem Diamantgitter eine Teilstruktur heraus: einen Sessel, die drei “Auf-Atome” der darüberliegenden Schicht und das diese drei Atome verbindende Atom der wiederum darüber liegenden Schicht (vgl. (2) in Abb. 6.7). Dieser Ausschnitt stellt einen völlig regelmäßigen Käfig dar, der aus vier Sesseln gebildet ist: dieser Käfig findet sich in regelmäßiger Abfolge nur im Diamantgitter. Wenn man also mit diesem Käfig das Bauen beginnt und das zugrunde liegende Muster nicht verläßt, erhält man zwangsläufig das Diamantgitter. Dieser Gitterausschnitt ist das Skelett von C-Atomen eines Moleküls, das Adamantan genannt wird (vgl. Lehrbücher der Organischen Chemie).

Abb. 6.7: Verschiedene Beschreibungsweisen für die Diamantstruktur
3. Beschreibungsweise. Die Koordinationszahl eines C-Atoms im Diamantgitter ist vier: jedes C-Atom ist räumlich regelmäßig, also tetraedrisch von vier anderen C-Atomen gebunden. Dieser Tetraeder, der im Mittelpunkt ein Atom besitzt, wiederholt sich durch das ganze Diamantgitter. Er wiederholt sich aber auch im Hindurchlanggitter, insofern ist ein Tetraeder alleine noch keine fertige Beschreibungsweise für das Diamantgitter! Bei genauerer Betrachtung stellt man allerdings fest, daß das Eck-Atom eines Tetraeders gleichzeitig das Zentrum-Atom des nächsten Tetraeders ist. Schneidet man aus einem Diamantgitter zwei benachbarte Tetraeder heraus, erhält man ein Gebilde aus acht Atomen (vgl. (1) und (3) in Abb. 6.7). Man kann es anhand zweier Tetraeder beschreiben, die über die Spitzen so ineinander hineingeschoben sind, daß die beiden Spitzen zum Mittelpunkt des jeweils anderen Tetraeders werden. Diese Formation findet sich in unterschiedlicher Position sowohl im “Nicht-Hindurchlanggitter”, als auch im “Hindurchlanggitter: Im ersten Gitter sind die gegenüberstehenden Grundflächen der beiden Tetraeder immer gegeneinander um 60° gedreht, im zweiten sind sie in Stapelrichtung deckungsgleich.
Als Beschreibungsweise für den Diamanten kann uns daher nur der Doppeltetraeder mit den um 60° gedrehten Grundflächen dienen: Nimmt man diesen Ausschnitt konsequent als Bauelement, führt dies zwingend zur Diamantstruktur.
4. Beschreibungsweise. Wie wir gesehen haben, ist die Diamantstruktur anhand einer regelmäßigen Anordnung von Tetraedern beschreibbar. Da nun Tetraeder je nach Ansicht ein Dreiecks- oder Quadratmuster bilden können, entspricht die senkrechte Aufsicht auf die Sessel dem Dreiecks- bzw. Sechseckmuster. Kippt man nun das Diamantgitter so, daß alle Tetraeder mit zwei Kanten parallel zur Tischebene angeordnet sind, erhält man in der Draufsicht bzw. in der senkrechten Projektion ein Quadratmaschenmuster, das auch als flächenzentriertes Quadratmuster beschrieben werden kann. Auf diese Weise kann man einen flächenzentrierten Würfel aus dem Diamantgitter herausschneiden.
Die Positionen innerhalb dieses Würfels besitzen die Anordnung der kubisch dichtesten Kugelpackung, in der jede zweite Tetraederlücke besetzt ist. Dieser flächenzentrierte Würfel mit halber Besetzung der Tetraederlücken wird wegen der hohen Symmetrie des Würfels als Elementarzelle für das Diamantgitter gewählt (vgl. (4a) in Abb. 6.7, die besetzten Tetraederlücken sind mit den Zahlen 1 - 4 markiert). Dies ist die bekannteste Beschreibungsweise des Diamanten.
Es ist nicht einfach, den flächenzentrierten Würfel in das Gitter einzubeschreiben, wenn man die Struktur anhand der Sesselbauweise (Beschreibung 1) erstellt hat. Völlig analog ist die Fragestellung, den flächenzentrierten Würfel aus der kubisch dichtesten Kugelpackung zu isolieren, wenn man mit Dreiecksmaschen bzw. Sechseckmaschen und Schichtenfolge ABCA gebaut hat. Am übersichtlichsten zeigt sich der Zusammenhang, wenn man vom Adamantangerüst (vgl. (2) in Abb. 6.7) ausgeht, das aus 10 C-Atomen besteht. Wählt man davon sechs Atome, so daß kein Atom direkt benachbart ist, bilden diese zusammen einen Oktaeder (vgl. (4b) in Abb. 6.7). Diese sechs Atome sind in der Gesamtstruktur mit denen identisch, die oktaedrisch die Flächenzentren des flächenzentrierten Würfels bilden. Der Würfel steht demnach mit seiner Raumdiagonalen senkrecht zu den Sesselschichten: Jeweils eine Flächendiagonale wird von zwei an den Ecken gekoppelten Tetraedern gebildet, das beiden Tetraedern gemeinsame C-Atom ist das Flächenzentrum.
5. Beschreibungsweise. Man kann sich diesen Gitterausschnitt auch anhand des kubisch raumzentrierten Gitters veranschaulichen: Acht kubisch raumzentrierte Zellen werden zu einem großen Würfel zusammengestellt (vgl.(5) in Abb. 6.7). Anschließend werden den acht Teilwürfeln je vier Ecken entfernt, die zusammen einen Tetraeder bilden. Schließlich wird abwechselnd jedes zweite Zentrum der acht Teilwürfel herausgenommen, so daß insgesamt vier Raumzentren 1 - 4 verbleiben (vgl. (4a) der Abb. 6.7).
6. Beschreibungsweise. Die kubische Elementarzelle des Diamantgitters enthält genau 18 Positionen für C-Atome (4. Beschreibungsweise): Diese kann man in genau fünf Flächen parallel zur Grundfläche wiederfinden (vgl. (6) der Abb. 6.7). Wir können aus dem Würfel “Scheiben herausschneiden” und deren “Stockwerkshöhe” angeben. Bezeichnen wir die Grundfläche mit der Stockwerkshöhe Null und die identische Deckfläche mit der Höhe 1, dann besitzen zwei Positionen in den Tetraederlücken die Höhe ¼, die vier Positionen der Flächenzentren der Seitenflächen die Höhe ½, die nächsten beiden Positionen in den Tetraederlücken die Höhe ¾, und die Deckfläche die Höhe 1. Diese fünf Quadratschnitte aus dem Würfel ergeben die eindeutige Information, wie die C-Atome im Diamantgitter anzuordnen und für das gesamte Gitter weiterzuverknüpfen sind.
7. Beschreibungsweise. Die Angabe der Atompositionen in Höhenschnitten (6. Beschreibungsweise) ist für manche Fällen noch informativer, wenn man die fünf Höhenschnitte durch eine größere Zahl von nebeneinander und hintereinander gereihten Elementarzellen legt (vgl. (7) der Abb. 6.7): Das Diamantgitter ist durch Stapeln von Quadratmaschen eindeutig darstellbar. Die Ebenen der Quadratmaschen müssen allerdings von Stockwerk zu Stockwerk jeweils um ¼ der Kantenlänge der Elementarzelle in der richtigen Richtung verschoben werden.
Fullerene. Es gibt noch weitere Strukturen, die durch Verknüpfung von C-Atomen realisiert werden. So kennt man beispielsweise seit den 80er Jahren eine dritte Modifikationsfamilie des Kohlenstoffs: die Fullerene. Sie enthalten Molekülen, die aus sehr vielen C-Atomen aufgebaut sind und kugelförmig geschlossenen Käfigen gleichen. Im Gegensatz zum metallisch leitenden Graphit und zum isolierenden Diamant sind Fullerene halbleitende Materialien. Sie sind weich wie Graphit, besitzen eine schwarz-braune Farbe und lösen sich in organischen Lösungsmitteln: etwa mit roter Farbe in Benzol oder Toluol.
Das bekannteste Fulleren ist das Buckminster-Fulleren: Das entsprechende kugelförmige Molekül ist aus 60 C-Atomen aufgebaut, jedes C-Atom mit drei Bindungen der Normbindefähigkeit 1,33 ist mit drei weiteren C-Atomen verknüpft (vgl. (1) und (2) in Abb. 6.8). Die Struktur gleicht dem Aufbau eines üblichen Lederfußballs aus 12 fünfeckigen und 20 sechseckigen Lederflicken (vgl. (3) in Abb.
6.8): ebenso sind C5-Ringe und C6-Ringe im C60-Molekül verknüpft.
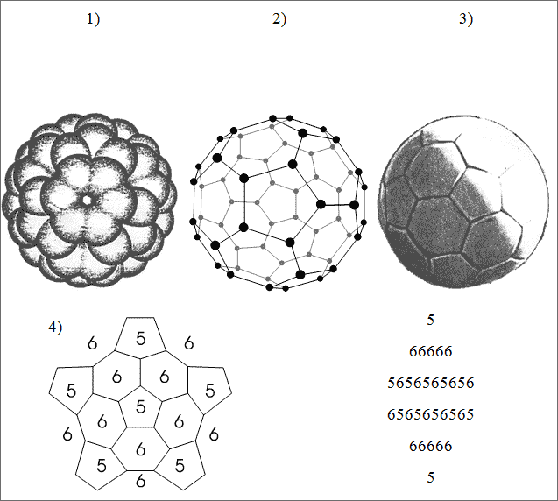
Abb. 6.8: Molekülmodelle für das Buckminsterfulleren-Molekül, Vergleich mit einem Fußball aus fünfeckigen und sechseckigen Lederflicken
Beim Bau des Molekülmodells ist darauf zu achten, daß die C5-Ringe immer isolierte Ringe sind und von jeweils fünf C6-Ringen geformt werden. Beginnt man mit einem Fünfring, so umgibt man ihn mit fünf C6-Ringen (66666). Darauf folgen dann 10 Ringe der Abfolge 5656565656, wiederum 10 Ringe der inversen Abfolge 6565656565. Schließlich sind 5 Sechsringe zu formen (66666), die einen letzten Fünfring bilden (vgl. (4) in Abb. 6.8). Verzichtet man auf die Forderung der isolierten Fünfringe, so lassen sich 1812 Isomere für C60-Moleküle bauen!
Silicium, Germanium, Zinn. Si-Atome und Ge-Atome bauen beide nur in einer einzigen Art, nämlich in der Art wie sich C-Atome im Diamantgitter verknüpfen. Auch die Sn-Atome erinnern sich an die eigentliche Verwandtschaft mit den Atomen der 4. Hauptgruppe und setzen sich unterhalb einer Temperatur von 13,2°C in der Art des Diamantgitters zusammen, es wird α-Zinn genannt. Es gibt oberhalb der genannten Temperatur eine andere Struktur der Sn-Atome, auf die wir später zurück kommen. Sn-Atome realisieren nur keine der bekannten Metallstrukturen - obwohl jedermann das Zinn als Metall kennt.
Chemische Symbole
Wir haben die Strukturen einiger Moleküle und Gitter kennengelernt. Es ist nun für den Chemiker viel zu langwierig und aufwendig, im alltäglichen Umgang mit den Substanzen ständig Strukturmodelle zur Hand zu nehmen. Deshalb sind für die Substanzen Symbole eingeführt worden, deren Informationsgehalt gegenüber den Modellen zwar verkürzt ist, die aber einfach und schnell zu handhaben sind. Sie müssen allerdings so ausgewählt werden, daß die gewünschte Information noch erhalten bleibt. Das hängt zum einen vom Zweck der Information ab, zum anderen vom Adressaten, an den die Information gerichtet ist.
Zur Kurzinformation stehen uns zwei Arten von Symbolen zur Verfügung: Struktursymbole und Summensymbole. Dazu werden die Buchstabensymbole der einzelnen Atomsorten verwendet.
Ein Struktursymbol oder eine Strukturformel für Moleküle soll folgende Information enthalten:
1. Teilchenart
2. Bindungspartner
3. Bindungsgrad
Als zusätzliche Spezialinformation hat sich bewährt:
4. Bindungswinkel
5. Bindungslänge
Im allgemeinen erhält man gut brauchbare Struktursymbole, wenn man die Strukturmodelle der Moleküle auf ein Blatt Papier projiziert und die gerichteten Bindefähigkeiten mit Bindestrichen symbolisiert. Will man keine Aussage über den Bindungsgrad machen, kann man beispielsweise dem Bindestrich Pünktchen unterlegen.
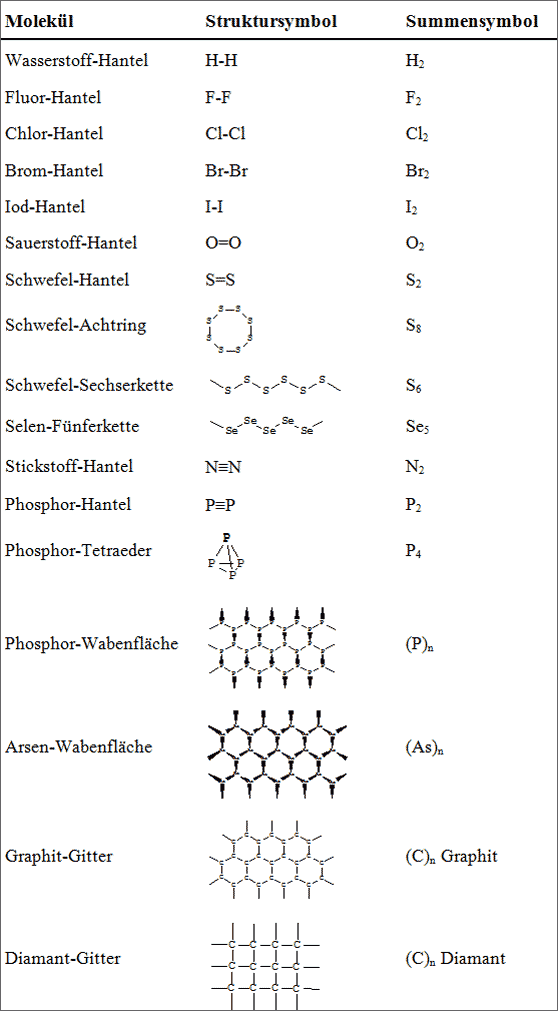
Tab. 6.1: Chemische Symbole für Moleküle und Gitter, die aus einer Art von Nichtmetall-Atomen bestehen
Ein Summensymbol oder eine Summenformel reiht lediglich die Atomsymbole der im Molekül verknüpften Atome auf. Über die Anzahl der zum Molekülbau verwendeten gleichen Atome wird am jeweiligen Atomsymbol rechts unten durch einen kleinen Zahlenindex informiert. Man beachte jedoch, daß aus einem Summensymbol keinerlei Rückschlüsse auf den Bau des Moleküls gezogen werden können. Daher werden Summensymbole oft für sehr kleine und häufig vorkommende Moleküle benutzt, deren Strukturen jedem Benutzer bekannt sind. Je größer und unbekannter aber die Moleküle werden, desto weniger wert ist solch ein Summensymbol zur Information. Die in den vorangehenden Abschnitten erläuterten Moleküle und Gitterstrukturen können symbolisiert werden, wie in Tabelle 6.1 angegeben.
Soll anhand des Summensymbols eine große, unbestimmte Menge von Teilchen bezeichnet werden, wird das Symbol eingeklammert und mit einem Buchstabenindex n für “große Zahl” versehen. Um die Unterschiede von Graphit- und Diamantgitter zu verdeutlichen, werden diese Namen auch dazu notiert.
![]()


