3.6 Stärke und Normung bei räumlich ungerichteter Bindefähigkeit
3.6.1 Normung der Bindefähigkeit von Ionen
Die Ionen, so wie sie z. B. im Periodensystem angeführt sind,
lassen sich in einer ungeheuren Vielfalt miteinander koppeln. Diese
Vielfalt experimenteller Beobachtungen stellt die Frage nach einem
Ordnungsprinzip, nach dem sich die einzelnen Ionen miteinander verknüpfen
lassen.
Diese Ordnung zu finden ist weitaus schwieriger als bei den gerichteten
Bindefähigkeiten. Bei ungerichteten Bindefähigkeiten kann
die Anzahl der gekoppelten Teilchen prinzipiell nicht beschränkt
sein, weil es nur auf den verfügbaren Platz, auf die Geometrie
ankommt.
Ionen besitzen die Eigenschaft, sich gegenseitig anzuziehen oder abzustoßen.
Kationen untereinander und Anionen untereinander stoßen sich
gegenseitig ab. Das macht keine andere Teilchensorte. Atome mit gerichteten
Bindefähigkeiten tun dies nicht, Atome mit ungerichteten Bindefähigkeiten
ebenfalls nicht: Bei all diesen Teilchen kommen nur Anziehungskräfte
zum Tragen.
Wenn Ionen verknüpft werden, dann muß das anziehende und
abstoßende Prinzip gegenseitig ausgeglichen sein. Als beschreibende
Größe dient uns hier die Eigenschaft der Ionenladung. Zunächst
machen wir dazu ein Gedankenexperiment, das die Kraftwirkung von Ionen
in Analogie zur Massenanziehung aufzeigt (vgl. (1) und (2) in Abb.
3.15).
Nehmen wir als Normmasse die Erde und hängen zwei unterschiedlich
schwere Kugeln an eine Federwaage. Zeigt die Federwaage bei der zweiten
Kugel die doppelte Kraftwirkung an, so kann die Masse dieser Kugel
beispielsweise 2 kg und die der ersten Kugel mit 1 kg bezeichnet werden.
Nehmen wir einen Gegenstand mit konstantem, negativ geladenem elektrischen
Feld (etwa eine geriebene Folie, vgl. (2) in Abb. 3.15) und messen
die Kraft, mit der ein positiv geladenes Lithium-Ion angezogen wird.
Das gleiche wiederholen wir mit einer positiven elektrischen Fernwirkungsquelle
und messen die Kraftwirkung auf ein negatives Fluor-Ion. Die Messung
ergibt, daß die Kraftwirkung auf beide Ionen, auf das Lithium-Ion
und auf das Fluor-Ion, genau gleich groß ist. Jetzt werden alle
anderen Ionen ebenfalls im elektrischen Fernwirkungsfeld vermessen
und ihre Kraftwirkungen bestimmt. Wir setzen das positive Lithium-Ion
und das negative Fluor-Ion als Norm und geben an, um wieviel mal stärker
das "Test-Ion" im elektrischen Feld angezogen wird als ein
Lithium- oder Fluor-Ion. Die Abbildung (2) symbolisiert etwa ein Ca2+-Ion,
das eine doppelt so starke Kraftwirkung zeigt.
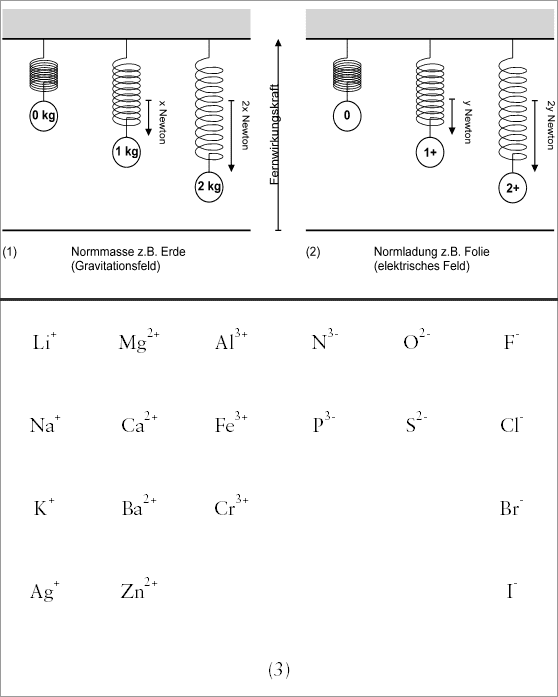 Abb 3.15: Ionenladungen als Maß für
Kraftwirkungen
Abb 3.15: Ionenladungen als Maß für
Kraftwirkungen
Von den positiven Ionen besitzen Natrium-, Kalium- und Silber-Ionen die
gleiche Kraftwirkung wie ein Lithium-Ion. Magnesium-, Calcium- und Zink-Ionen
besitzen die zweifache, Aluminium-Ionen, manche Eisen- oder Chrom-Ionen
die dreifache, manche Blei-Ionen sogar die vierfache Kraftwirkung eines
Lithium-Ions.
Diese Kraftwirkungen können auch im Experiment nachgewiesen werden.
Man hat daraufhin die Größe der elektrischen Ladung gekennzeichnet:
1+, 2+, 3+ oder 4+. Einige Beispiele positiv geladener Ionen und entsprechender
Ionensymbole zeigt (3) in Abbildung 3.15.
Die Normung der negativen Ionen erfolgt genauso in einem positiven
elektrischen Feld. Es werden die entsprechenden Kraftwirkungen der negativen
Ionen bestimmt und mit der des Fluor-Ions verglichen, dem die Normladung
1- zugeordnet ist. Die Ladungen der Ionen werden als Vielfaches der Ladung
des Fluor-Ions angegeben. Abbildung 3.15 zeigt ebenfalls einige Beispiele.
Mit den Ladungszahlen der Ionen beschreiben wir die elektrischen
Bindekräfte um das Ion herum. Koppeln wir mehrere Ionen zusammen,
dann nehmen die Ionen mit ihren Fernwirkungskräften ihre Plätze
so ein, daß bei gleicher Anzahl und gleichmäßiger Verteilung
von positiven und negativen Ladungen Anziehung und Abstoßung ausgewogen
und stabil sind. Man sagt auch, der Teilchenverband ist elektrisch ausgeglichen
oder elektrisch neutral.
Abbildung 3.16 zeigt zweidimensionale Modellvorstellungen von Ionenverbänden,
die "elektrisch ausgeglichen" genannt werden. Die Bilder dieser
Abbildung sind Ausschnitte aus beliebig großen Flächen und geben
das Bauprinzip an, wie die Ionen im Verband zu verknüpfen sind.
In Bild (1) ist jedes positive Ion mit der Ladung 1+ von vier negativen
Ionen mit der Ladung 1- umgeben und gleichzeitig jedes Ion mit der Ladung
1- von vier anderen Ionen: Jedes Ion mit der Ladung 1- wird somit von der
Ladung 4+ eingehüllt und jedes Ion mit der Ladung 1+ von der Ladung
4-.
In Darstellung (2) ist jedes "2+Ion" von vier "1-Ionen" umgeben,
und gleichzeitig jedes "1-Ion" von zwei "2+Ionen".
Somit ist ebenfalls jedes "1-Ion"von der Ladung 4+ eingehüllt,
jedes "2+Ion"durch die Ladung 4-.
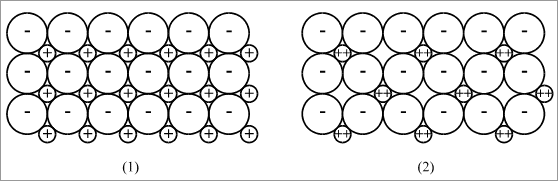 Abb. 3.16: Modellvorstellungen für elektrisch
ausgeglichene Ionenverbände
Abb. 3.16: Modellvorstellungen für elektrisch
ausgeglichene Ionenverbände
Die Normung der Ionenladung anhand der Li+-Ionen oder F--Ionen hat
den Vorteil, daß wir die Ionen ihrer gleichen elektrischen
Kraftwirkung nach ordnen und verwenden können. Außerdem
ergibt die Forderung der elektrischen Neutralität beim Zusammenbau
von Ionen die Voraussagen des Anzahlenverhältnisses, in dem
wir die Anionen und Kationen bereitstellen müssen. In Fall
(1) muß das Zahlenverhältnis der Ionen A+ : B- = 1 :
1 sein, im Fall (2) A2+ : B- = 1 : 2. Über die Anzahl der
entgegengesetzt geladenen Ionen, die mit einem einzelnen Ion verknüpft
werden können, ist jedoch keine allgemeine Aussage möglich.
![]()


