Einleitung
Unsere Welt ist aus Millionen verschiedener Substanzen zusammengesetzt. Auf welchem Wege sind die vielen natürlichen Stoffe und künstlich geschaffenen Substanzen unserer Welt zu ordnen und zu systematisieren ? Wie ist die Fülle dieser Stoffe zu reduzieren und für Lehre bzw. Unterricht durch exemplarisches Vorgehen zugänglich zu machen ?
Eine Möglichkeit bietet sich über Prinzipien im Aufbau der vielen Substanzen an, über die chemischen Strukturen. Wir haben bei unserem Quereinstieg in die Chemie ein Periodensystem der Elemente (PSE) zugrunde gelegt, das in Anlehnung an das Atommodell von Dalton sowohl Atomsorten als auch Ionen-sorten ausweist (siehe Seite 2: Atome und Ionen - Grundbausteine der Materie. Abbildung aus Band 1). Modellmäßig werden diese Grundbausteine der Materie als Kugeln unterschiedlicher Größe dargestellt und mit Eigenschaften versehen (vgl. Band 1): so besitzen sie beispielsweise bestimmte Massen und Binde-kräfte besonderer Qualität.
Die Bindefähigkeiten sind bei Metall-Atomen („links im PSE“) räumlich ungerichtet: um ein Metall-Atom herum gruppieren sich im unendlich- infiniten Kristallgitter je nach Struktur 8 bis 12 weitere Metall-Atome. Im Band 2 werden diese Strukturen beschrieben und benannt. Die Elementarkörper der drei Metallstrukturen werden in der Abbildung auf Seite 3 abgebildet.
Nichtmetall-Atome („rechts im PSE“) betätigen räumlich gerichtete Bindefähigkeiten und verknüpfen sich überwiegend zu abgeschlossenen oder finiten Molekülen einer bestimmten Zahl von Atomen. Die Modellvorstellungen von der Bindigkeit 4 des C-Atoms, der Bindigkeit 2 des O-Atoms und der Bindigkeit 1 des H-Atoms reichen aus, um den Aufbau vieler Moleküle organischer Substanzen zu verstehen oder die Molekülstrukturen mit einem Molelkülbaukasten zu veranschaulichen.
Ionen („links und rechts im PSE“) beschreiben wir analog den Metall-Atomen mit ungerichteten Bindefähigkeiten: je nach Größe der Ionenarten bilden sich bestimmte infinite Strukturen. Die Ionen besitzen allerdings zusätzlich die Eigenschaft, elektrisch geladen zu sein und je nach Art und Größe dieser Ladung Anziehungs- und Abstoßungskräfte auszuüben, darüber hinaus müssen sich die Ionenladungen im Ionengitter elektrisch ausgleichen. Diese Prinzipien führen zu bestimmten Kristallstrukturen der Salze, wie sie in diesem Band exemplarisch ausgewählt und beschrieben werden.
Bei der Beschreibung der meisten Salzstrukturen werden oftmals bestimmte Packungen der Anionen zugrunde gelegt und darin gedanklich in einem bestimmten Ausmaß die Lücken durch Kationen gefüllt. Sowohl die Grundstrukturen der Metalle als auch die Art der Lücken in den entsprechenden Kugelpackungen sind im Band 2 ausführlich vorgestellt worden. Insofern sollte der Anfänger diesen Band 2 zur Hand haben, um gewisse Strukturinformationen nachlesen zu können.
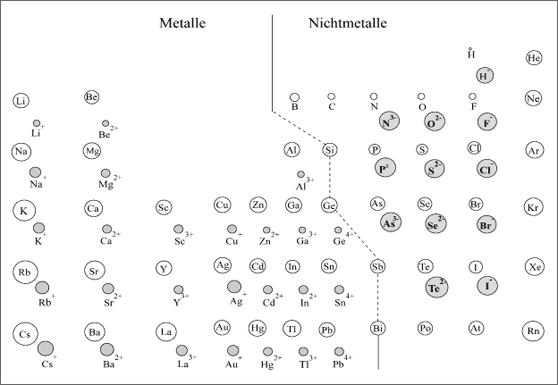
Abbildung aus Band 1: Atome und Ionen - Grundbausteine der Materie
Es kann auch vorteilhaft sein, bestimmte Strukturelemente aus Kugeln zu bauen und bereit zu legen, um sich den dreidimensionalen Bau der beschriebenen Strukturen besser vorstellen zu können, als es zweidimensionale Zeichnungen zulassen. So wird mit den abgebildeten Strukturelementen in der Abbildung dieser Seite der Bau der hexagonalen Kugelpackung (a) und die Koordinationszahl 12 anschaulich, die kubisch dichteste oder kubisch flächenzentrierte Kugelpackung mit der Koordinationszahl 12 durch die beiden Elementarkörper (b) und (c), schließlich die kubisch raum- oder innenzentrierte Kugelpackung mit der Koordinationszahl 8 durch den Bau des Raumkörpers (d).
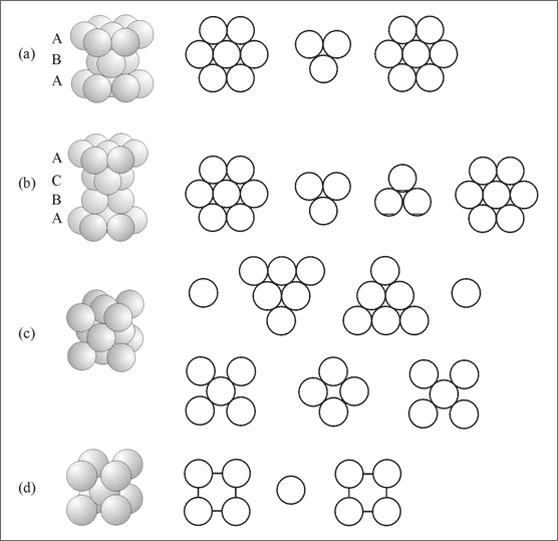
Strukturelemente aus Band 2: Elementarkörper der hexagonal dichtesten Kugelpackung (a), der kubisch dichtesten oder kubisch flächenzentrierten Kugelpackung (b und c) und der kubisch innenzentrierten oder raumzentrierten Kugelpackung (d)
![]()


