7.5.1 Gleichzeitige Besetzung von Oktaeder- und Tetraederlücken
In einer dichtesten Kugelpackung lassen sich gleichviele Oktaederlücken wie Kugeln auffinden und doppelt so viele Tetraederlücken: das Zahlenverhältnis von Kugeln : Oktaederlücken : Tetraederlücken beträgt 1 : 1 : 2. In dichtesten Packungen von Anionen lassen sich entsprechend der Ionenladungen gleichzeitig sowohl die Oktaederlücken als auch die Tetraederlücken ganz oder teilweise mit Kationen besetzen.
Beispiel Spinell. Die bekannteste Substanz dieser Art der Besetzung ist der Spinell. Er ist beschreibbar als kubisch dichteste Kugelpackung von Oxid-Ionen, wobei die Hälfte der Oktaederlücken mit Aluminium-Ionen Al3+ und ein Achtel der Tetraederlücken mit Magnesium-Ionen Mg2+ besetzt sind. Erstaunlich ist, daß die etwas größeren Magnesium-Ionen in den kleineren Lücken, und die kleineren Aluminium-Ionen in den größeren Oktaederlücken sitzen. Mit ein Grund dafür ist sicher, daß die negative Umgebung von sechs O2--Ionen in der Oktaederlücke größer ist als die von vier O2--Ionen in der Tetraederlücke. Insofern ist das höher geladene Aluminium-Ion stärker in der Oktaederlücke eingebunden.
Das Summensymbol wird anhand des Zahlenverhältnisses der Ionen gebildet. Nehmen wir an, 100 Oxid-Ionen bilden die kubisch dichteste Kugelpackung, das entspricht ebenfalls 100 Oktaederlücken und 200 Tetraederlücken. Von den Oktaederlücken sind nur 50 mit Al3+-Ionen besetzt und von den Tetraederlücken nur 25 mit Mg2+-Ionen. Daraus ergeben sich die Symbole (Mg2+)25(Al3+)50(O2-)100 bzw. (Mg2+)1(Al3+)2(O2-)4 bzw. MgAl2O4.
Die allgemeine Bauweise des Spinells ist somit schnell beschrieben. Aufwendiger wird die Beschreibung, wenn man die Positionen der Teilchen zueinander im Gitter genau angeben will. Dazu müssen wir drei zusätzlichen Fragen nachgehen:
1. Nach welchem System wird die Hälfte der Oktaederplätze besetzt ? Es gibt mehrere Möglichkeiten, beispielsweise 50 Kugeln auf einer Fläche anzuordnen, auf der 100 Plätze zur Verfügung stehen.
2. Nach welchem System wird das Achtel der Tetraederlücken besetzt ? Es gibt auch in diesem Fall verschiedene Möglichkeiten, von allen Tetraederlücken im Raum jede achte Lücke zu besetzten.
3. In welcher Strukturbeziehung stehen die Teilchen in den Oktaederlücken zu den Teilchen in den Tetraederlücken ?
Diese drei Strukturfragen sind nicht überblickbar, wenn wir, wie sonst üblich, nur einen flächenzentrierten Elementarwürfel mit den Positionen der Oxid-Ionen herausgreifen. Im Durchschnitt könnten wir zwar in solch einem Würfel zwei Oktaederlücken und eine Tetraederlücke besetzen: das entspricht aber nicht der wirklichen Teilchenanordnung im Raum. Tatsächlich sind in einem flächenzentrierten Würfel zwei Tetraederlücken besetzt und im benachbarten Würfel gar keine. Daher ist es übersichtlicher, wenn wir die Kantenlänge des Würfels verdoppeln und damit acht flächenzentrierte Zellen als Gesamtwürfel betrachten (vgl. (1) in Abb. 7.20).
Oktaederlückenfüllung. Eine kubisch dichteste Kugelpackung mit halber Füllung der Oktaederlücken ist uns bereits beim Gitter des Cadmiumchlorids CdCl2 begegnet: dort haben wir den Würfel auf die Raumdiagonale gestellt und die Oktaederlückenschichten zwischen den dichtest gepackten Schichten abwechselnd besetzt. Beim Spinell gilt ein anderes Lückenfüllsystem. Es ist jede Oktaederlückenschicht nur teilweise besetzt, wobei sich der Grad der Besetzung abwechselnd ändert. Wir kommen später darauf zurück.
Zu Beginn erhalten wir den besten Überblick, wenn wir die Quadratmaschenbauweise der kubisch dichtesten Kugelpackung betrachten: darin stellt jede Quadratmasche eine Oktaederlücke dar. Diese Quadratmaschenschichten werden nun halb mit Teilchen gefüllt, und zwar reihenweise: eine Reihe von Oktaederlücken wird gefüllt, die benachbarte Reihe bleibt leer, usw. Sowohl alle gefüllten benachbarten Oktaeder als auch alle leeren benachbarten Oktaeder sind je über eine gemeinsame Kante zu diesen Reihen verknüpft (vgl. (2) in Abb. 7.20).
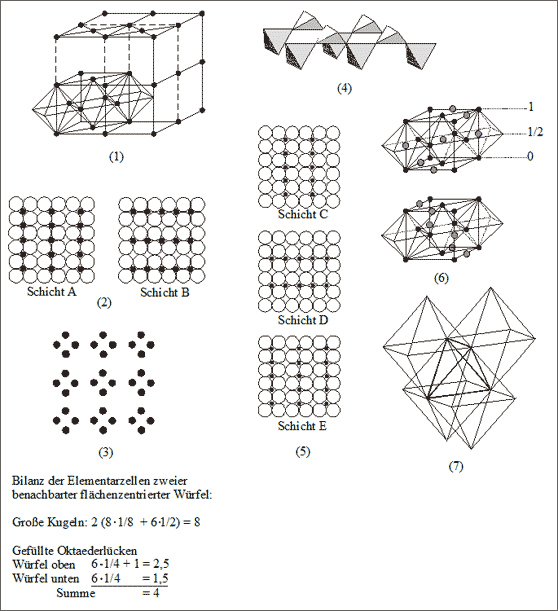
Abb. 7.20: Modellvorstellungen zur Oktaederlückenfüllung im Spinellgitter ( MgAl2O4)
![]()
Die Schichten A und B sollen nun aufeinandergepackt werden. Die großen Teilchen der Schicht B rasten über den Oktaederlücken der Schicht A als Deckkugeln ein und bilden die Oktaederspitzen. Dadurch kommen die eingelagerten Teilchen der Schicht B genau als Querreihen über die eingelagerten Teilchen der Schicht A. Betrachten wir die eingelagerten Teilchen für sich, so ist zu erkennen, daß die beiden oberen Teilchen an den Reihenkreuzungen jedesmal mit den beiden unteren Teilchen einen Tetraeder bilden, der auf der Kante steht. Die Tetraeder sind über die Ecken miteinander verknüpft, Kantenrichtungen und Kantenhöhen der Tetraeder sind mit den Richtungen und Reihen der eingelagerten Teilchen identisch (vgl. (3) und (4) in Abb. 7.20).
In die Schicht C (vgl. (5) in Abb. 7.20) werden die Teilchen wieder reihenweise senkrecht zur Anordnung der vorhergehenden Schicht eingelagert, also in der gleichen Richtung wie in Schicht A. Die Stapelung auf Schicht B muß aber nun so erfolgen, daß die eingelagerten Teilchen sich nicht mit Schicht A decken, sondern die Positionen der leeren Reihen der Schicht A einnehmen. Die großen Teilchen sind natürlich mit Schicht A deckungsgleich.
In der Schicht D liegen die Einlagerungsreihen wieder senkrecht zur vorhergehenden Schicht. Obwohl die großen Teilchen deckungsgleich mit Schicht B sind, müssen die Reihen der eingelagerten Teilchen den leeren Reihen von Schicht B entsprechen. Die Schicht E ist in allen Aspekten identisch mit Schicht A.
Betrachtet man die Lage der gefüllten Oktaederlücken in den flächenzentrierten Elementarwürfeln, so erhält man unterschiedliche Strukturen: zwei Beispiele seien abgebildet und zeigen das Zahlenverhältnis der großen Kugeln und der gefüllten Oktaederlücken von 2 : 1 (vgl. (6) in Abb. 7.20). Die Bilanz zeigt, daß in den Elementarzellen beider abgebildeter Elementarwürfel bekannterweise acht große Kugeln und acht Oktaederlücken gezählt werden, allerdings besetzen in der Summe nur vier kleine Kugeln die verfügbaren acht Oktaederlücken. Diese Lücken sind also nur zur Hälfte besetzt, der Besetzungsgrad dieser Lücken beträgt dementsprechend 1/2.
Ein letztes besonderes Strukturmerkmal für die Oktaederlücken, die in der kubisch dichtesten Anionenpackung zur Hälfte mit Kationen besetzt sind (vgl. (7) in Abb. 7.20): vier lückenbesetzte Oktaeder bilden immer einen Tetraeder, der gerade nicht durch ein Kation besetzt ist. Besetzungsgrad und Struktur der besetzten Tetraederlücken im Spinellgitter werden im nächsten Abschnitt vorgestellt.
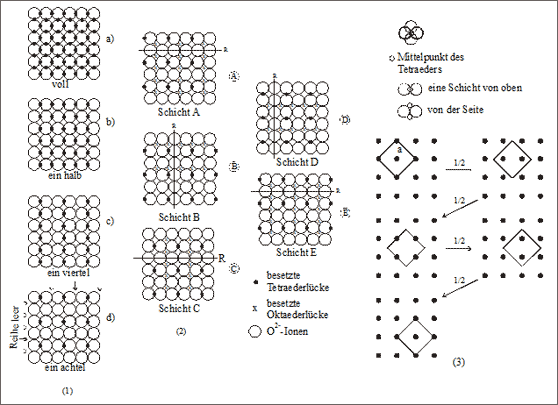
Abb. 7.21: Modellvorstellungen zur Tetraederlückenfüllung im Spinellgitter ( Al2O3)
![]()
Tetraederlückenfüllung. Wenn wir zwei Schichten von Kugeln im Quadratmaschenmuster zur dichtesten Kugelpackung stapeln, dann befinden sich die Mittelpunkte der Tetraederlücken in der senkrechten Projektion unter den Berührungspunkten der Kugeln. Wie bei der Suche nach besetzten Oktaederlücken versuchen wir auch hier, die Plätze des Achtels der besetzten Tetraederlücken möglichst gleichmäßig auf der Quadratmaschenflächen zu verteilen (vgl. (1) in Abb. 7.21). Zunächst zeigt (1a) die voll besetze Fläche. Entfernen wir jede zweite Reihe, so erhalten wir eine halbe Besetzung mit kleinen Kugeln (1b). Nehmen wir weiter in einer Reihenrichtung jedes zweite Kugel heraus, erhalten wir eine 1/4- Besetzung (1c). Entfernen wir zusätzlich in der anderen Reihenrichtung ebenfalls jede zweite Kugel, dann erhalten wir eine 1/8-Besetzung (1d).
Es ist besonders zu beachten, daß die verbleibenden Teilchen der besetzten Tetraederlücken auf der Fläche in einem weiten Quadratmuster im Abstand von zwei großen Kugeldurchmessern angeordnet sind. Das spielt bei der Stapelung der Flächen dann eine besondere Rolle. Außerdem berührt kein besetzter Tetraeder einen anderen ebenfalls besetzten Tetraeder über eine gemeinsame Ecke. Die besetzten Tetraeder sind also alle für sich isoliert.
Wir müssen uns an unsere Aufgabe zurückerinnern. Es sollen Al3+-Ionen und Mg2+-Ionen in ein Gerüst von O2--Ionen eingeordnet werden. Um die Kraftwirkungen zwischen den Ionen auszugleichen, müssen die Ionen möglichst gleichmäßig im Raum verteilt sein. Bei den Aluminium-Ionen und der Besetzung der Hälfte der Oktaederlücken ist dies bereits gelungen. Da sowohl Magnesium-Ionen als auch Aluminium-Ionen positiv geladen sind, stoßen sie sich gegenseitig ab.
Wir müssen demnach die Metall-Ionen möglichst weit voneinander entfernt in die Lückenschichten einbauen. Stellen wir uns wiederum eine Quadratmaschenschicht aus der kubisch dichtesten Kugelpackung mit halber Besetzung der Oktaederlücken durch Eliminierung jeder zweiten Reihe vor (vgl. (2) in Abb. 7.20). Der Abstand der Teilchen in den Oktaederlücken beträgt von Reihe zu Reihe zwei große Kugeldurchmesser.
Insofern besitzen also beide Reihen, die besetzten Oktaederreihen und die besetzten Tetraederreihen den gleichen Abstand. Es ist daher naheliegend, die Reihe der Tetraederlücken-Teilchen zwischen die Reihe der Oktaederlücken-Teilchen zu plazieren (vgl. (2b) in Abb. 7.21). Zur Stapelung einer Kugelpackung wählen wir die Schichten A bis E wie zuvor und behalten auch das Stapelsystem bei - wir besetzen lediglich jede Schicht zusätzlich mit Tetraederlücken-Teilchen.
In Schicht A ist eine Reihe mit R gekennzeichnet (vgl. (2) in Abb. 7.21). Sie ist vollkommen leer, also weder von Oktaeder- noch von Tetraeder-Teilchen besetzt. Diese Reihe wiederholt sich immer nach zwei Kugeldurchmessern. In diese Reihen rasten die Oktaederreihen der Schicht B ein. Die Tetraederreihen könnten zunächst direkt übereinander liegen, also Quadrat über Quadrat. Das ist aber nicht zulässig, weil dann zwei benachbarte Tetraeder mit Teilchen besetzt wären. Die Abstände von Tetraeder-Kation zu Tetraeder-Kation wären nicht gleich. Gleiche Abstände sind zu erhalten, wenn wenigstens eine Tetraederreihe im Zwischenraum einer darunterliegenden Tetraederreihe liegt. Das Quadratmaschennetz der Tetraeder-Teilchen ist gegenüber der darunterliegenden Schicht um eine halbe Seitenlänge des Quadrates quer verschoben worden, sodaß sich nur noch zwei Seiten der Quadrate auf einer Linie befinden.
Die Stapelung der nächsten Schicht C erfolgt nach dem gleichen System: Einrasten der Oktaederreihe in eine völlig leere Reihe der Schicht B mit anschließendem Einpassen der Tetraeder-Teilchen durch Verschieben des Quadrates in einer Richtung. Diesmal ist aber die Verschiebung der Quadrate der Schicht C gegenüber der Schicht B nicht quer, sondern senkrecht um eine halbe Seitenlänge erforderlich. Die Schicht D wird wiederum nach dem gleichen System eingepaßt. Diesmal ist die Verschiebung um eine halbe Seitenlänge des Quadrates wiederum quer erfolgt.
Die Schicht E, nach dem gleichen System gestapelt, ist wieder deckungsgleich mit der Schicht A. Die Verschiebung des Quadrates der Schicht E gegenüber der vorhergehenden Schicht erfolgte wieder senkrecht.
Die Verschiebung der Quadratmaschen wird für sich allein nochmals dargestellt (vgl. (3) in Abb. 7.21). Man kann sich vorstellen, daß das auf der Diagonalen stehende Quadrat mit der Seitenlänge a festgehalten und das kleine Quadratmaschennetz dahinter quer bzw. senkrecht vorbeigezogen wird. Anhand dieser Abfolge von Quadratmaschennetzen haben wir die Struktur des Diamantgitters als 7. Beschreibungsweise beschrieben (vgl. Band 3). Die Mg2+-Ionen in den Tetraederlücken des Spinellgitters befinden sich demnach in den Positionen des Diamantgitters.
Die Al3+-Ionen ordnen sich im Spinellgitter jeweils zwischen den O2--Ionen in der Art, wie die Sauerstoff-Teilchen zwischen den Silicium-Teilchen im Cristobalit-gitter (vgl. Band 3). Die Mg2+-Ionen sind angeordnet wie die C-Atome im Diamantgitter. Wie sind diese beiden Gitter aber gegenseitig zugeordnet ?
Struktur der Oktaeder- und Tetraederlückenbesetzung. Zur Beantwortung dieser Frage betrachten wir zunächst eine Schicht der kubisch dichtesten Kugelpackung, die zwei Schichten von besetzten Oktaederlücken zeigt (vgl. (1) in Abb. 7.22). Wir haben die Positionen der Oktaederlücken anhand von Tetraederketten beschrieben: das Zentrum zwischen den vier tetraedrisch angeordneten Oktaederlücken ist identisch mit einer Tetraederlücke der dichtesten Kugelpackung.
Wir erinnern uns weiterhin daran, daß die Oktaederlücken völlig gleichmäßig zur Hälfte gefüllt sind: dann müssen die leeren Lücken zusammen das gleiche System ergeben wie die gefüllten Lücken. Die leeren Lücken sind deshalb in (1) ebenfalls eingezeichnet und ihre Anordnung bestätigt diese Tatsache: alle leeren Oktaederlücken müssen ebenfalls die Positionen der Sauerstoff-Teilchen im Cristobalitgitter einnehmen.
Die Silicium-Teilchen im Cristobalitgitter bilden ein Diamantgitter, entsprechen also den Zentren der Sauerstoff-Tetraeder. Diese Plätze sind wiederum identisch mit den Zentren zwischen den tetraedrisch angeordneten Oktaederlücken. Die gefüllten Tetraederlücken fallen mit den tetraedrischen Zentren der nicht gefüllten Oktaederlücken zusammen (1): um einen gefüllten Tetraeder befinden sich nur leere Oktaeder. Sie sind mit der Fläche gekoppelt - genau umgekehrt wie bei den gefüllten Oktaedern, an deren Flächen nur leere Tetraeder anstoßen.
Die Zuordnung der räumlichen Anordnung von Teilchen in den Oktaederlücken zur Anordnung der Teilchen in den Tetraederlücken können wir demnach folgendermaßen formulieren: Ein Cristobalitgitter und ein Diamantgitter sind invers, also umgekehrt ineinandergestellt. Betrachtet man nur die Zentren, die Schwerpunkte der Sauerstoff-Tetraeder des Cristobalits, so stellen diese ebenfalls ein Diamantgitter dar. Die beiden Diamantgitter lassen sich dann so beschreiben, daß die flächenzentrierten Würfelauschnitte beider Gitter um eine halbe Kantenlänge gegeneinander verschoben sind (vgl. (2) in Abb. 7.22). Man erhält im Prinzip einen Würfel, der aus acht raumzentrierten Würfeln zusammengesetzt ist. Um jedes Zentrum sind die Würfelecken aber abwechselnd mit Teilchen der beiden Diamantgitter besetzt (vgl. 5. Beschreibungsweise des Diamantgitters in Band 3).
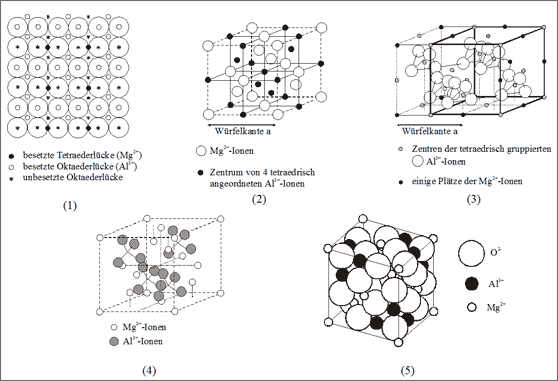
Abb. 7.22: Vorstellungen zur Tetraeder- und Oktaederlückenbesetzung
![]()
Anhand der Abbildungen können wir demnach verfolgen: Der um die halbe Kantenlänge verschobene Würfel des Diamantgitters (schwarze Punkte) ist von der Kubooktaederform der kubisch dichtesten Kugelpackung abgeleitet. Im Zentrum und auf allen Kantenmitten sitzt ein Teilchen, außerdem aber noch zusätzlich je eines in vier Würfelecken weisend um das Zentralteilchen.
Setzen wir an die Stelle eines Teilchens in dieser Darstellung das leere tetraedrische Zentrum, das von vier Oktaederlücken-Teilchen gebildet wird., dann verbleibt auf den Kantenmitten lediglich das gedachte Zentrum (vgl. (2) in Abb. 7.22). Die vier Oktaederlücken-Teilchen gehören somit auch zu den benachbarten Würfeln, an deren Ecken Mg2+-Ionen angesiedelt sind. Im Würfel mit der Kantenlänge a, aber um eine halbe Kantenlänge verschoben, befindet sich dann nur ein Tetraeder im Zentrum von weiteren vier Tetraedern tetraedrisch umgeben (vgl. (3) in Abb. 7.22).
Wie bereits erwähnt, entspricht die Zuordnung der Mg2+-Ionen zu den Al3+-Ionen im Spinellgitter zwei ineinandergestellten Diamantgittern, wobei das eine mit Kugeln, das andere mit Tetraedern gebaut wird (vgl. (4) in Abb. 7.22). Die tetraedrisch angeordneten Teilchen entsprechen den Positionen der Al3+-Ionen und die andren Teilchen den Mg2+-Ionen. Der Würfel, der von den Mg2+-Ionen aufgespannt wird, ist aus (2), (3) und (4) der Abbildung 7.22 ersichtlich, den voll gepackten Würfelausschnitt des Spinells zeigt (5) in Abb. 7.22.
Es sei jedoch darauf hingewiesen, daß dieser Würfelausschnitt mit den Magnesium-Ionen an den Würfelecken nicht identisch ist mit dem Ausschnitt von acht mit Oxid-Ionen besetzten flächenzentrierten Würfeln. Der Würfel mit den Magnesium-Ionen an den Ecken ist zwar genauso groß, aber in allen drei Raumrichtungen um ein Achtel der Kantenlänge verschoben. Das entspricht einem Viertel der Kantenlänge eines einfachen flächenzentrierten Würfels.
Diese Verschiebung verlegt das beschreibende Koordinatensystem vom Zentrum eines Magnesium-Ions in das Zentrum eines Oxid-Ions (vgl. (2) in Abb. 7.23), wie aus den quadratischen Ausschnitten einer Würfelfläche ersichtlich. Wählt man als Ecken Oxid-Ionen, so fallen drei Magnesium-Ionen als Eckbesetzungen des flächenzentrierten Quadrats in benachbarte Zellen. Das ist der Grund, daß man in einem kleinen Gitterausschnitt, der sich an den Oxid-Ionen orientiert, ohne Hintergrundwissen die Diamantgitter-Anordnung der Magnesium-Ionen nicht erkennt. Wenn man jedoch neun flächenzentrierte Würfel zu einem Riesenwürfel mit der Kantenlänge "drei Würfel" zusammenbaut, ist die Diamantgitter-Anordnung der Magnesium-Ionen sofort erkennbar.
Koordination der Ionen. Wir haben die Spinellstruktur beschrieben als kubisch flächenzentrierte Packung von Oxid-Ionen, deren Oktaederlücken zur Hälfte mit Aluminium-Ionen besetzt und deren Tetraederlücken zu einem Achtel mit Magnesium-Ionen gefüllt sind. Nach der Beschreibung der Zuordnung der Lückenteilchen zueinenader bleibt schließlich die Frage, welche Koordinationszahlen auftreten.
Zunächst ist offensichtlich, daß ein Mg2+-Ion von vier Oxid-Ionen umgeben ist, also die Koordinationszahl 4 gilt. Ebenso deutlich wird ein Al3+-Ion von sechs Oxid-Ionen koordiniert, diese Koordinationszahl lautet 6. Wie lautet die Koordination aber für ein Oxid-Ion ?
Dazu betrachten wir nochmals unsere Stapelschichten (vgl. Abb. 7.21 und (1) in Abb. 7.23). Wenn alle Oktaederlücken gefüllt wären, wäre in einer Schicht jedes Oxid-Ion quadratisch von vier Oktaederlücken-Teilchen umgeben. Infolge der abwechselnden reihenweisen Entfernung dieser Lückenteilchen wird nun jedes Oxid-Ion in einer Schicht nur noch von zwei Teilchen im Winkel von 90° umgeben.
Die Tetraederlücken-Teilchen sind zwischen den Reihen der besetzten Oktaederlücken so angeordnet, daß sie in der Schicht ein Oxid-Ion als drittes Kation umgeben. Es ist zu beachten, daß der Mittelpunkt der Tetraederlücke höher liegt als das Zentrum des Oktaeders und daß - über die Kante verbunden - eine zweite Tetraederlücke direkt darunter liegt. Ein Tetraederlücken-Teilchen versorgt dabei in einer Schicht zwei Oxid-Ionen, allerdings wird dabei nur die Hälfte der Oxid-Ionen bedient. Die andere Hälfte erhält die Nachbarschaft durch Füllung von Tetraederlücken der darunterliegenden Schicht.
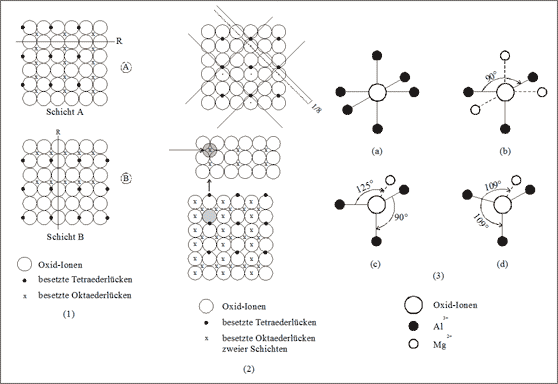
Abb. 7.23: Koordination der Ionen im Spinellgitter (MgAl2O4)
![]()
Wir zeichnen zu den Oktaederlücken einer Schicht ebenfalls die auf dieser Schicht liegenden, gefüllten Oktaederlücken (vgl. (2) in Abb. 7.23) und schraffieren ein gedachtes Oxid-Ion, das bereits von zwei Oktaeder-Teilchen und einem Tetraeder-Teilchen umgeben ist. Bei der Stapelung rastet dieses gekennzeichnete Teilchen genau über der gefüllten Oktaederlücke ein (die Lücke ist durch einen Pfeil markiert): das Oxid-Ion wird von drei Aluminium-Ionen und einem Magnesium-Ion koordiniert. In der Spinellstruktur gilt das für alle Oxid-Ionen in dieser Weise.
Diese Koordinationsverhältnisse werden mit denen im NaCl-Gitter verglichen und nochmal systematisch zusammengestellt (vgl. (3) in Abb. 7.23). Im Kochsalzgitter werden die Chlorid-Ionen oktaedrisch durch Natrium-Ionen koordiniert, alle Winkel sind 90° (3a). Wir entfernen die Hälfte der gedachten Natrium-Ionen in der Art, daß eine Eckstruktur übrig bleibt. Die verbleibenden drei Teilchen sollen den Aluminium-Ionen der Spinellstruktur entsprechen, nur die Winkel noch nicht. Bleiben die drei Winkel vorläufig 90° (3b), so weist das Magnesium-Ion in der zugehörigen Tetraederlücke jeweils einen Winkel von 125° zu den drei Teilchen der Oktaederlücken auf (3c). Nun verschieben sich die Teilchen der dichtesten Kugelpackung alle ganz wenig gegeneinander, sodaß sich die Winkel von 90° und von 125° gegenseitig zum Tetrae-derwinkel von 109° angleichen (3d).
Weitere Spinelle. In der Spinellstruktur als sehr dicht gepackter Ionenpackung können sich eine große Vielzahl verschiedener Ionen verknüpfen. Diese Spinelle sind relativ hart und treten infolge möglicher Ionenvariationen in vielfältigen Farbtönen auf. Sie werden deshalb auch als Halbedelsteine geschätzt.
Zunächst tauschen wir gedanklich die Aluminium-Ionen in den Oktaederlücken gegen andere dreifach positiv geladene Ionen aus, beispielsweise gegen Cr3+ oder Co3+. So erhalten wir etwa den Chromspinell (Mg2+)1(Cr3+)2(O2-)4 bzw. MgCr2O4.
Weiterhin lassen sich die Magnesium-Ionen durch viele andere zweifach positiv geladene Ionen ersetzen, etwa durch Zn2+, Ni2+, Fe2+ und viele andere mehr. Die Verknüpfung von Zink-Ionen mit Aluminium-Ionen ergibt den Zinkspinell (Zn2+)1(Al3+)2(O2-)4 bzw. ZnAl2O4, aus zweifach geladenen Eisen-Ionen und den Aluminium-Ionen erhalten wir den Eisenspinell (Fe2+)1(Al3+)2(O2-)4 bzw. FeAl2O4.
Ein bekannter Spinell läßt sich aus Fe2+-Ionen und Fe3+-Ionen zusammenbauen. Allerdings vertauschen in diesem Fall die zweifach positiven mit den dreifach positiven Ionen ihre Plätze. Die Hälfte der Fe3+-Ionen setzt sich in die Tetraederlücken, die Fe2+-Ionen besetzen mit der zweiten Hälfte der Fe3+-Ionen die Oktaederlücken. Dieser Spinell heißt Magnetit oder Magneteisenstein. Er bildet sich in schönen dunkelbraunen oktaederförmigen Kristallen aus und besitzt - wie der Name besagt - magnetische Eigenschaften. Schreiben wir im Summensymbol die Tetraederlücken-Teilchen zuerst, dann formulieren wir (Fe3+)1(Fe2+Fe3+)1(O2-)4. Fassen wir die Teilchensorten ohne Rücksicht auf ihre Plätze zusammen, so erhalten wir (Fe2+)(Fe3+)2(O2-)4. Lassen wir auch die Ionenladungen weg, dann schrumpft das Summensymbol zu Fe3O4 zusammen. Ohne weitere Hintergrundkenntnisse ist das übliche Symbol Fe3O4 eine im wahren Sinn des Wortes fragwürdige Information !
Der geschilderte Lückentausch ist auch in anderen Spinellen üblich. Spinelle dieser Variation werden als inverse Spinelle bezeichnet.
Der Austausch der Ionen der Tetraederlücken ist in bestimmten Fällen sogar auch dann möglich, wenn die Ionenladung nicht zweifach positiv ist. Nehmen wir an, wir setzen ein einfach positives Ion an einen Tetraederplatz: es fehlt uns eine positive Ladung. Das kann aber dadurch ausgeglichen werden, daß wir in die nächste erreichbare Tetraederlücke ein Ion einsetzen, das dreifach positiv geladen ist. Wir können das soweit betreiben, bis die Hälfte der besetzbaren Tetraederplätze mit einfach positiven Ionen und die andere Hälfte mit dreifach positiven Ionen besetzt ist.
Solche Ausgleichsoperationen sind ebenfalls in großer Variationsbreite möglich, solange sich im Durchschnitt die positiven Ionenladungen zur Ladung 2+ mitteln lassen. Als Beispiel soll die Kombination von einfach positiven Lithium-Ionen mit Aluminium-Ionen dienen. Diese sollen zunächst ordnungsgemäß alle im Spinell-gitter vorhandenen Oktaederlücken füllen. Dann besetzen wir abwechselnd die Tetraederlücken mit Li+ und Al3+-Ionen. Die Bilanz gibt folgendes, wenn wir beispielsweise von 800 Oxid-Ionen ausgehen:
| O2--Ionen für die Kugelpackung | 800 |
| Al3+-Ionen zur Füllung der verfügbaren Oktaederlücken | 400 |
| Li1+-Ionen zur halben Füllung der verfügbaren Tetraederlücken | 100 |
| Al3+-Ionen zur halben Füllung der verfügbaren Tetraederlücken | 100 |
Das entspricht einem Summensymbol (Li1+)100(Al3+)100(Al3+)400(O2-)800 oder (Li1+)1(Al3+)1(Al3+)4(O2-)8 bzw. LiAl5O8.
Je weiter man in der Spinellstruktur bestimmte Ionen austauscht und zwischen den Oktaeder- und Tetraederlücken hin- und herschiebt, desto mehr wird der Ausdruck Spinell zum allgemeinen Begriff. Schließlich wird er allgemein verwendet, wenn die gleichzeitige Besetzung von Oktaederlücken und Tetraederlücken einer kubisch dichtesten Packung gekennzeichnet werden soll - selbst wenn nicht alle Plätze ordnungsgemäß besetzt sind.
Das bekannteste Beispiel dafür ist eine Kombination nur aus dreifach positiven Eisen-Ionen Fe3+ und Oxid-Ionen O2-. Wir haben eine Konstruktionsmöglichkeit bereits kennengelernt unter dem Substanznamen Hämatit. In dieser Substanz bilden aber die Oxid-Ionen eine hexagonal dichteste Kugelpackung mit Besetzung von zwei Dritteln der Oktaederlücken. Im Magnetit bauen Fe2+- und Fe3+-Ionen zusammen eine inverse Spinellstruktur: die Tetraederlücken sind bereits mit Fe3+-Ionen besetzt, die Fe2+-Ionen befinden sich mit in den Oktaederlücken. Wenn wir nun die Fe2+-Ionen gegen Fe3+-Ionen austauschen, dann müssen wir nach jedem Austausch von zwei Fe2+-Ionen eine Lücke freilassen, denn sonst wird die positive Ladung zu groß. Wir dürfen also nur zwei Drittel der Plätze mit Fe3+-Ionen besetzen, an denen vorher Fe2+-Ionen angesiedelt waren.
Machen wir wiederum eine Bilanz, indem wir von 1200 Oxid-Ionen ausgehen, die die kubisch dichteste Kugelpackung bilden:
| O2--Ionen der dichtesten Kugelpackung | 1200 |
| Fe3+-Ionen zur Füllung der verfügbaren Tetraederlücken | 300 |
| Fe3+-Ionen zur halben Füllung der verfügbaren Oktaederlücken | 300 |
| Fe3+-Ionen zur Füllung von zwei Dritteln der verbleibenden Hälfte der verfügbaren Oktaederlücken | 200 |
Ein Sechstel der im Spinell verfügbaren Oktaederlücken bleibt somit unbesetzt, nämlich 100 Plätze von insgesamt 600. Verschiebt man einige Fe3+-Ionen aus den Tetraederlücken statistisch in Oktaederlücken, dann bleiben von insgesamt 900 verfügbaren Oktaeder- und Tetraederlücken 100 unbesetzt, also ein Neuntel. Das Summensymbol dieser Substanz lautet (Fe3+)800(O2-)1200 bzw. (Fe3+)2(O2-)3 bzw. Fe2O3. Um diese Substanz mit dem Spinellgitter vom Hämatit anhand des Summensymbols zu unterscheiden, bezeichnet man diese Modifikation mit dem griechischen Buchstaben Gamma: γ- Fe2O3. Diese Bauweise wird auch als Spinellstruktur mit Leerstellen bezeichnet, die Substanz besitzt wie Hämatit ferromagnetische Eigenschaften.
Der Spinellstruktur liegt die kubisch dichteste Kugelpackung zugrunde. Das strukturmäßige Pendant anhand der hexagonal dichtesten Kugelpackung bilden Magnesium- oder Eisen-Ionen (Fe2+), Silicium-Ionen (Si4+) und Oxid-Ionen, wobei die Silicium-Ionen ein Achtel der Tetraederlücken und die Magnesium-Ionen bzw. die Eisen-Ionen die Hälfte der Oktaederlücken besetzen. Sind alle Oktaederlücken mit Magnesium-Ionen gefüllt, dann erhält man das Mineral Forsterit mit dem Summensymbol (Mg2+)2(Si4+)1(O2-) bzw. Mg2SiO4.
Bei voller Besetzung der Oktaederlücken mit Eisen-Ionen heißt das entsprechende Mineral Fayalit, das Summensymbol lautet (Fe2+)2(Si4+)1(O2-)4 bzw. Fe2SiO4. Sind die Oktaederlücken von zwei Ionensorten beliebig sowohl mit Eisen-Ionen als auch mit Magnesium-Ionen besetzt, erhält man das Mineral Olivin mit dem Summensymbol (Fe2+, Mg2+)2(Si4+)1(O2-)4 bzw. (Fe, Mg)2SiO4. Olivin ist an der Bildung der Gebirge aus Urgestein beteiligt. Schöne olivgrüne Einzelkristalle sind als Halbedelsteine geschätzt (Bauanleitung für die Struktur siehe Band 5). Ein weiterer Halbedelstein aus Aluminium-Ionen, Beryllium-Ionen und Oxid-Ionen mit der Olivin-Struktur ist der Chrysoberyll mit dem Summensymbol (Al3+)2(Be2+)1(O2-)4 bzw. Al2BeO4
Die Koordinationsverhältnisse sind in der hexagonalen Anordnung dem kubischen Spinell völlig entsprechend. Im Forsteritgitter werden die Magnesium-Ionen von sechs, die Silicium-Ionen von vier Oxid-Ionen umgeben. Ein Oxid-Ion ist von drei Magnesium-Ionen und einem Silicium-Ion gemeinsam nahezu tetraedrisch umlagert. Die Zuordnung von gefüllten zu leeren Oktaeder- und Tetraederlücken ist ebenso wie im Spinell. Eine besetzte Tetraederlücke besitzt als Flächennachbarn nur unbesetzte Oktaeder und Tetraeder. Zwei besetzte Tetraeder teilen ebenfalls keine gemeinsamen Ecken, sie sind völlig für sich isoliert.
![]()


