7.4.4 Zahlenverhältnis der Ionen von 2 : 3
Wir haben die Besetzung einer Oktaederlückenschicht bereits diskutiert (vgl. 7.16). Läßt man beim Schichten zu einer Kugelpackung jeweils die nächste Schicht vollständig unbesetzt, so ergibt sich insgesamt eine 1/3-Besetzung in der Kugelpackung (Beispiel CrCl3). Schichtet man allerdings ausschließlich 2/3 besetzte Schichten übereinander, so erhält man auch eine 2/3-Besetzung der Kugelpackung.
Beispiel Korund. Bilden wir mit Oxid-Ionen eine hexagonal dichteste Kugelpackung und besetzen jede Oktaederlückenschicht zu zwei Drittel mit Aluminium-Ionen (vgl. (a) Abb. 7.19): dann erhalten wir die Korund-Struktur. Alle Al3+-Ionen sind oktaedrisch von sechs O2--Ionen umgeben, die O2--Ionen werden von vier Al3+-Ionen berührt, es berühren jeweils zwei von unten und zwei von oben. Die Koordinationszahlen sind 6 : 4, entsprechend beträgt das Zahlenverhältnis der Ionen 3 : 2. Das Summensymbol lautet (Al3+)2(O2-)3 bzw. Al2O3.
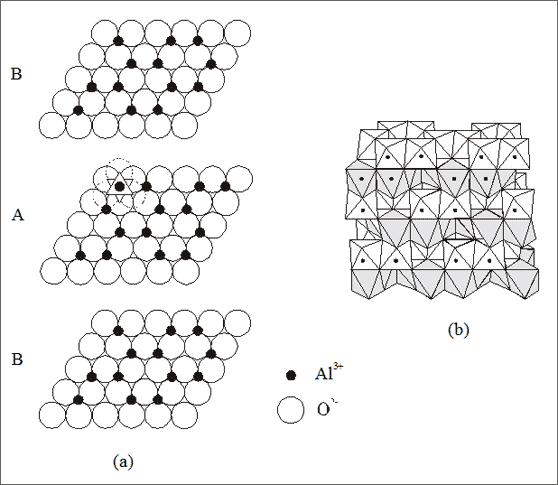
Abb. 7.19: Modellvorstellungen zu Schichten im Aluminiumoxid-Gitter (Korund, Al2O3)
Das Aufeinanderschichten der hexagonalen Schichten erfolgt wiederum regelmäßig. Kennzeichnet man die besetzten Lücken mit Oktaedern, so gelangt man zu einer Oktaederanordnung, die entsprechend den unbesetzten Lücken Hohlräume aufweist (vgl. (b) in Abb. 7.19).
Korundkristalle sind verhältnismäßig hart. Sehr reine Kristalle sind farblos, wobei durch geringe Mischkristallbildung mit anderen Teilchenarten eine bunte Vielfalt von Farbtönen erreicht werden kann. Diese farbigen Korundsorten sind als Halbedelsteine sehr geschätzt (Rubine, Saphir; siehe Seite 49). Ebenfalls in Korund-Struktur ordnen sich Eisen-Ionen Fe3+ und O2--Ionen an: die Kristalle heißen Hämatit, das zugehörige Summensymbol lautet (Fe3+)2(O2-)3 bzw. Fe2O3.
![]()


