7.3 Chemische Symbole zur Beschreibung von Ionengittern
Wie bereits angedeutet, liegen in vielen Salzkristallen die Ionen in gleichartigen Strukturen verknüpft vor, wie etwa Metall-Atome in Einlagerungsmischkristallen bei den Legierungen angeordnet sind. Insofern werden auch die Ionenkristalle mit der gleichen Symbolsprache beschrieben wie Legierungsmischkristalle: die Struktur von Molybdännitrid beispielsweise kann als kubisch dichteste Packung von Mo-Atomen mit Füllung aller Oktaederlücken durch N-Atome interpretiert werden: durch Abzählen erhält man ein Zahlenverhältnis der Atome von 1 : 1 und damit das Symbol Mo1N1 bzw. MoN (vgl. Band 2).
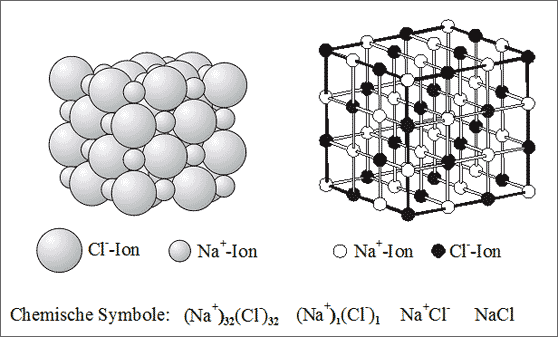
Abb. 7.3: Kugelpackung und Raumgitter des NaCl-Ionengitters
Ersetzt man in dieser Struktur alle Mo-Atome durch Cl--Ionen und alle N-Atome durch Na+-Ionen, so erhält man die Struktur des Ionengitters der bekannten Substanz Kochsalz (vgl. Abb. 7.3). Natrium-Ionen und Chlorid-Ionen sind demnach im Zahlenverhältnis 1 : 1 zusammengesetzt. Nach den gleichen Regeln wie bei der Bildung der Symbole der Mischkristalle können wir nun das Symbol für Kochsalz ausführlich formulieren als
(Na+)1(Cl-)1
Die kleinen Indices rechts unten am Ionensymbol geben das Zahlenverhältnis der zum Kristallbau verwendeten Ionen an. Im allgemeinen wird auch hier der Index 1 weggelassen. Das Symbol wird dann zu
(Na+)(Cl-)
Nun kommt hinzu, daß die Ionen relativ spät in der Chemiegeschichte (etwa ab 1890) als Bausteine erkannt und anerkannt worden sind. In früheren Zeiten war zwar klar, daß Kochsalz aus irgendwelchen Natrium- und Chlor-Teilchen besteht, die Teilchen wurden aber für Atome gehalten. Insofern konnte zwischen Atomen und Ionen auch symbolisch nicht unterschieden werden und das Symbol für die Kochsalzstruktur ist mit den Atomsymbolen formuliert worden:
NaCl
Das ist bis heute so geblieben: zur Beschreibung eines Ionenkristalls werden nur in Sonderfällen die Ionensymbole verwendet. Und trotzdem liest der Chemiker in das Symbol NaCl die Ionen hinein, weil er die Substanz kennt. Das bedarf für den Chemieanfänger besonderer Übung beim Lesen solcher Symbole, denn er muß sich blitzschnell für Atome oder Ionen als Bausteine der Substanz entscheiden können, ohne die entsprechenden Symbole zu sehen.
Das kann man durch Anwendung unserer Kombinationsregeln relativ gut erreichen. Nehmen wir an, uns begegnet das Symbol CaO: offensichtlich sind irgendwie Calcium-Teilchen und Sauerstoff-Teilchen im Zahlenverhältnis 1 : 1 zusammengesetzt. Wenn wir die Einordnung der Grundbausteine im Periodensystem kennen, also die 2. Hauptgruppe und 6. Hauptgruppe, wissen wir, daß Teilchen nach unserer Regel "links + rechts" gekoppelt worden sind. Demnach muß es sich um Ionen handeln. Die Ladung der Ionen in der 2. Hauptgruppe ist 2+, die Ladung der Ionen in der 6. Hauptgruppe 2-. Sicher wäre ein Symbol
(Ca2+)1(O2-)1
klarer und bequemer zu lesen. Zum einen stehen aber allgemein jeder Umstellung in der Symbolik viele Hindernisse im Weg, zum anderen kann in komplizierteren Fällen tatsächlich nicht zwischen Atom und Ion entschieden werden. Deshalb ist es üblich, die undifferenzierten Atomsymbole in Summenformeln zu verwenden und sich von Fall zu Fall durch "Abtasten" der Summensymbole eine Strukturvorstellung zu verschaffen.
Wie wichtig das "Abtasten" - auch einfachster Summensymbole - sein kann, zeigt eine Gegenüberstellung der Symbole
CuZn, NaCl und HCl .
Alle drei Symbole sind formal gleich. Die einzigen Informationen, die man ohne Zusatzkenntnisse aus den Symbolen entnehmen kann, sind zwei Teilchensorten, die jeweils im Zahlenverhältnis 1 : 1 zum Bau einer Substanz verwendet werden: das ist alles. Ob Atom oder Ion, ob räumlich gerichtet oder ungerichtet verknüpft - darüber erhält man keine Information. Auch die unterschiedliche Bedeutung der unsichtbaren Indices 1 macht sich nicht bemerkbar. Die Schreibweise Na2Cl2 ist erlaubt und manchmal auch sinnvoll, denn die Indices geben nur das Zahlenverhältnis der beteiligten Teilchen an. Die Schreibweise H2Cl2 ist aber unsinnig, weil ein Molekül, das aus zwei H-Atomen und zwei Cl-Atomen aufgebaut ist, nicht existiert. Das H1Cl1-Molekül ist existent und vorstellbar als Hantel aus je einem H- und einem Cl-Atom.
Unser „Abtastraster“ sollte anhand der Kombinationsregeln rasch abrufen:
CuZn: links + links im PSE, Metall-Atome, räumlich ungerichtet
NaCl: links + rechts im PSE, Ionen, räumlich ungerichtet
HCl: rechts + rechts im PSE, Nichtmetall-Atome, räumlich gerichtet
Auch wenn mehr als zwei Ionenarten zusammengesetzt sind, bleiben diese Regeln erhalten. Man kann etwa Magnesium-Ionen, Aluminium-Ionen und Oxid-Ionen gedanklich verknüpfen: die Oxid-Ionen mögen eine dichteste Kugelpackung bilden und die Metall-Ionen irgendwelche Lücken besetzen. Das Summensymbol
MgAl2O4
signalisiert „links + links + rechts im PSE“, also Ionen in folgendem Zahlenverhältnis:
(Mg2+)1(Al3+)2(O2-)4
Symbole für Ionen-Mischkristalle. Ionensorten, die sich beliebig auf ihren Plätzen im Ionengitter vertreten können, werden im Symbol hintereinander angegeben, jedoch durch ein Komma voneinander getrennt und eingeklammert.
Nehmen wir an, Cl--Ionen bauen eine dichteste Packung und in allen Oktaederlücken sitzen K+-Ionen: wir würden das Summensymbol KCl erhalten. Es sollen nun beliebig Cl--Ionen gegen Br--Ionen ausgetauscht werden. Dann bedeutet
K(Cl,Br) : K+ : ∑(Cl-+ Br-) = 1 : 1
Wenn Chlorid-Ionen eine dichteste Kugelpackung bauen und alle Oktaederlücken mit Natrium-Ionen besetzt sind, kann man beliebig Natrium-Ionen gegeb Silber-Ionen austauschen. In diesem Fall bedeutet das Symbol
(Na,Ag)Cl : ∑(Na+ + Ag+) : Cl- = 1 : 1
Werden Kalium- und Magnesium-Ionen im Ionengitter mit Cl--Ionen verknüpft und sollen Chlorid- und Bromid-Ionen beliebig austauschbar sein, dann kennzeichnet man das so:
KMg(Cl, Br)3 : K+ : Mg2+ : ∑(Cl-+ Br-) = 1 : 1 : 3
Nehmen wir schließlich an, Oxid-Ionen bauen eine dichteste Packung und kleinere Metall-Ionen sitzen sowohl in Oktaederlücken als auch in Tetraederlücken. Als Summensymbol wird angegeben:
(Fe,Mg)(Al,Cr,Fe)2O4
Das bedeutet, daß am Bau dieses Kristalls folgende Ionen beteiligt sind: Fe2+, Mg2+, Al3+, Cr3+, Fe3+, O2-. Es resultiert das Zahlenverhältnis:
∑(Fe2+ + Mg2+) : ∑(Al3++ Cr3++ Fe3+) : O2- = 1 : 2 : 4
Wir werden bei unseren Betrachtungen soweit wie möglich immer in der Symbolik zwischen Ionen und Atomen unterscheiden. Dieser Hinweis erfolgt deshalb, weil die Tradition der Symbolik von Fachgebiet zu Fachgebiet unterschiedlich ist. Hauptsächlich im Schrifttum der Kristallographie und der Mineralogie wird als Sammelbegriff für Atome und Ionen durchweg "Atom" im Sinne von "Teilchen" verwendet. Der Grund liegt darin, daß die Kristallographen eigentlich nur am Platz der Teilchen interessiert sind und nicht - wie der Chemiker - am Teilchen selbst. Denn das Ziel des Chemikers ist es, das Teilchen aus einer Substanz herauszunehmen und mit anderen Teilchen zusammensetzen. Da ist es sehr wohl wichtig, ob er ein Ion oder Atom vor sich hat.
Der Mineraloge ist meistens mehr an den fertigen Kristallen interessiert als an den Teilchen selbst: Insofern muß auch er die Teilchen nicht so genau bezeichnen. Man darf sich also beim Lesen eines Lehrbuches zur Kristallographie oder zur Mineralogie nicht daran stoßen, wenn im Kochsalzkristall die Positionen der "Natriumatome" und "Chloratome" beschrieben werden. Die Kristallographen und Mineralogen wissen sehr genau, daß es sich dabei um Ionen handelt - und weil kein Zweifel besteht, sagen sie einfach nach wie vor "Atome".
Die Fähigkeit, zwischen Atomen und Ionen zu unterscheiden, hat man sehr rasch erworben - auch wenn man fälschlicherweise etwas von „Atomen“ liest, obwohl an der Stelle Ionen gemeint sind. Diesem Lernprozeß muß sich im Laufe der Zeit jeder Chemieanfänger unterwerfen.
![]()


