6.2.3 Atome der 6. Hauptgruppe
Die Elemente bzw. Atome der 6. Hauptgruppe tragen den Sammelnamen “Chalkogene”: Erzbildner. Die wichtigsten und häufigsten Vertreter sind Sauerstoff und Schwefel. Selen (Se) und Tellur (Te) sind selten, ihre Teichenkombinationen werden aber oftmals in der Elektroindustrie verwendet. Polonium (Po) ist auf der Erde nur in Spuren vorhanden, mit diesem Element werden wir uns nicht weiter befassen.
Die Atome von Sauerstoff, Schwefel, Selen und Tellur betätigen minimal zwei Normbindefähigkeiten. Die beim Koppeln entstehenden Konstruktionen werden nun wesentlich davon abhängen, an welcher Stelle die zweite Normbindefähigkeit am Atom im Vergleich zur ersten angreift. Beide Kraftwirkungen könnten entweder genau gegenüber wirksam sein oder in einem bestimmten Winkel.
Unzählige Messungen an Substanzen bzw. Teilchenkombinationen im Labor haben im Durchschnitt einen Winkel der Normbindefähigkeiten von 109,5° ergeben - die besondere Bedeutung dieses Winkels als Tetraederwinkel werden wir bei der Betrachtung der 4. Hauptgruppe näher erläutern. Zunächst ist nur festzuhalten, daß die beiden Normbindefähigkeiten bzw. Kraftwirkungen eines Atoms 6. Hauptgruppe einen bestimmten Winkel bilden. Dieser Winkel von 109,5° ist bei den üblichen Molekülbaukästen berücksichtigt. Je anspruchsvoller ein Molekülbaukasten ist, desto mehr Sorten unterschiedlicher Kugeln wird er enthalten, die sich in den Winkeln der Druckknöpfe unterscheiden. Dadurch ist dann eine Vielfalt von Modellen verschiedener Moleküle konstruierbar, die den Messungen an den echten Molekülen genau entsprechen. Für unsere Belange genügt aber zunächst der übliche Tetraederwinkel von 109,5°.
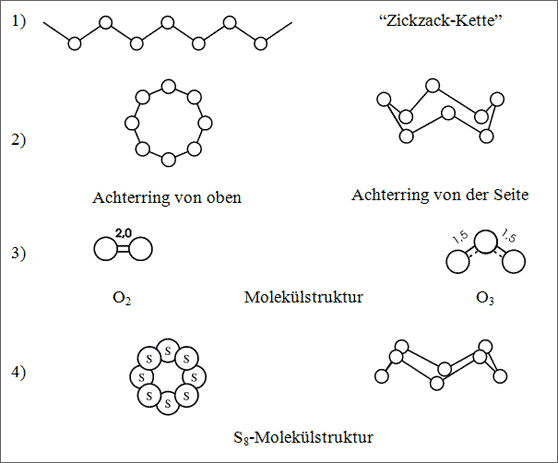
Abb. 6.2: Modelle zur Verknüpfung von Atomen mit zwei Bindefähigkeiten
Bei den Halogen-Atomen ist infolge einer einzigen gerichteten Bindefähigkeit nur eine einzige Molekülkonstruktion, nämlich die Hantel, möglich. Infolge der beiden gerichteten Normbindefähigkeiten an den Atomen erhalten wir jedoch drei prinzipiell unterschiedliche Konstruktionen von Molekülen: Ketten, Ringe und Hanteln.
Ketten. Durch Aneinanderkoppeln der Atome erhält man Ketten, die allerdings wegen der winklig angeordneten Kraftwirkungen am Atom „zick-zack-artig“ verlaufen, also Zickzack-Ketten sind (vgl. (1) in Abb. 6.2). Diese Ketten können lang oder kurz sein. Leider bleiben zunächst die Bindefähigkeiten am Anfang und am Ende der Kette ungesättigt - in der Praxis werden zur Absättigung an den Enden einer Atomkette oft irgendwelche anderen Teilchen angehängt, beispielsweise H-Atome. Sie fallen bei sehr langen Ketten von Zehntausenden von Atomen kaum ins Gewicht und werden deshalb nicht mit betrachtet.
Je kürzer die Kette allerdings wird, desto sorgfältiger muß man im Labor untersuchen, ob die endständigen Atome für das Gesamtverhalten des Moleküls eine Rolle spielen. Wenn die Kettenlänge nur drei Atome zählt, tragen die beiden Endpartner natürlich ganz erheblich zu den Eigenschaften des Moleküls bei - in solchen Fällen sind die beiden End-Atome immer mit anzugeben. Manchmal werden die endständigen Bindefähigkeiten in die Kette “hineingeklappt”, so daß sich die Bindekraft innerhalb der Kette von Atom zu Atom etwas über eine Normbindefähigkeit hinaus erhöht. Das wird für ein besonderes Sauerstoff-Molekül eine Rolle spielen.
Ringe. Beim Bauen von Ketten mit dem Molekülbaukasten bietet es sich fast von selbst an, die beiden Enden der Ketten miteinander zu verknüpfen: auf diese Weise erhalten wir Ringe. Sie werden durch einige Atomsorten realisiert. Wenn wir wiederum beachten, daß die Ketten gewinkelt sind, dann ist es selbstverständlich, daß auch die Ringe in sich gewinkelt sind (vgl. (2) in Abb. 6.2).
Die Größe der Ringe - also die Anzahl von Atomen, die einen Ring bilden - kann verschieden sein. Die kleinen Ringe mit bis zu vier Atomen sind allerdings sehr “verspannt”, sie sind deshalb in der Laborpraxis nur schwierig herzustellen. Sehr große Ringe sind mit dem Baukasten leicht zu fertigen - als Modell ist so eine Kette von 30 und mehr Kugeln beweglich und vollkommen unverspannt, man könnte sie sich wie eine Blumenkette um den Hals hängen. In der Laborpraxis liegt das Problem darin, daß sich die beiden Enden einer langen Kette nur sehr schwer oder gar nicht finden. Man muß sich einen Topf mit langen Spaghetti vorstellen und den einzelnen Spaghettinudeln den Auftrag geben, sich ihre eigenen Enden zu suchen und diese dann zu verknüpfen! Ein äußerst schwieriges Unternehmen! In der Praxis sind deshalb derartig große Ringe schwierig zu realisieren - Ringe mit einer Anzahl von 5 bis zu 8 Atomen kommen deshalb am häufigsten vor.
Hanteln mit Doppelbindung. Obwohl die beiden Normbindefähigkeiten ihre Wirkung im allgemeinen gewinkelt zeigen, können sich die beiden Bindefähigkeiten auch zu einer gemeinsamen Bindung zusammentun. Gleichsam wie die beiden winkelig abstehenden Zöpfe einer Mädchenfrisur zu einem einzigen, dicken Zopf zusammengeflochten werden können, so gehen die beiden Normbindefähigkeiten eines Atoms zu einer gemeinsamen Bindung zusammen: zwei Atome mit jeweils zwei Normbindefähigkeiten binden sich in Form einer Doppelbindung (vgl. auch Band 1). Bei einer Doppelbindung handelt es sich demnach um eine einzige Bindung von Atom zu Atom, die aber von zwei Normbindefähigkeiten gebildet wird. Bei den Atomen der 6. Hauptgruppe, die nur diese zwei Normbindefähigkeiten besitzen, erhält man dann einfache Hanteln (vgl. (3) in Abb. 6.2).
Wir kennen damit drei prinzipielle Verknüpfungsmöglichkeiten der Atome mit zwei Normbindefähigkeiten: Hanteln, Ringe und Ketten. Die Laborpraxis hat nun gezeigt, daß nicht bei jeder der Teilchensorten O, S, Se oder Te jede Bauweise gleich beliebt ist. Verfolgen wir die Teilchen der Hauptgruppe von oben nach unten, so ergeben sich folgende Regeln, die für die einzelnen Teilchensorten unterschiedliche Konsequenzen haben:
Die Tendenz zur Bildung von Ketten nimmt von oben nach unten zu.
Die Tendenz zur Bildung von Hanteln nimmt von oben nach unten ab.
Die Tendenz zur Bildung von Ringen ist in der Mitte am besten ausgeprägt.
Sauerstoff. Die O-Atome bilden untereinander im allgemeinen Hanteln: bestens bekannt als O2-Moleküle. Ringe von O-Atomen sind unbekannt, Ketten werden nur in Form der O3-Moleküle geknüpft: Ozon. Es sei an dieser Stelle besonders darauf hingewiesen, daß das Ozon-Molekül keinen Ring darstellt. Wenn es einen regelmäßigen Dreierring bilden würde, müßte der Winkel zwischen den Teilchen jeweils 60° betragen und die Abstände von Atom zu Atom müßten alle gleich sein. Das ist aber nicht der Fall: Messungen haben ergeben, daß zwei O-Atome an das mittlere O-Atom im Winkel von 117° und mit einem Abstand von 127,8 pm geknüpft sind.
Das Ozon-Molekül ist nicht einfach zu beschreiben. Eine Einfachbindung müßte den Abstand 148 pm, eine Doppelbindung etwa 120 pm haben: Infolgedessen muß bei einem Abstand von 127,8 pm der Bindungsgrad zwischen einer Einfach- und einer Doppelbindung liegen. Am besten hat sich bewährt, die beiden Bindungen von Atom zu Atom mit einem Bindungsgrad von 1,5 zu versehen. Dann müssen allerdings dem mittleren O-Atom drei Normbindefähigkeiten zugeordnet werden. Die sechs Normbindefähigkeiten der drei O-Atome sind jedenfalls so verteilt, daß die gleichmäßige Struktur (vgl. (3) in Abb. 6.2) im Labor bestätigt werden konnte.
Schwefel. Die S-Atome sind diejenigen, die sich am vielfältigsten knüpfen lassen. Hanteln mit Doppelbindung werden zwar gebildet, in größerem Maße allerdings Ketten und Ringe. Am häufigsten begegnet man Ringen, die aus acht S-Atomen zusammengesetzt sind: S8-Moleküle. Denkt man sich dieses ringförmige Molekül als Zickzack-Kette von acht S-Atomen, dann bleibt im Ring die “auf-ab-auf-ab”- Struktur voll erhalten, von der Seite betrachtet besitzt dieser Ring die Form einer Krone (vgl. (4) in Abb. 6.2). Man kann auch andere Bauweisen konstruieren, indem man die Folge der Atome im Ring mit “auf-ab-ab-auf” wählt, damit erhielte dann dieses ringförmige Molekül andere Eigenschaften. Solche Ringe sind aus der Laborpraxis allerdings nicht bekannt.
Der beschriebene Kronenring wirkt von oben gesehen wie ein regelmäßiges Achteck, wenn man die Mittelpunkte der acht Kugeln in Gedanken verbindet. Anstelle eines Achtecks kann man sich allerdings auch zwei Quadrate übereinandergelegt vorstellen, die gegeneinander um 45° gedreht sind (vgl. (4) in Abb. 6.2).
Selen, Tellur. Se- und Te-Atome bilden kaum Hanteln, allerdings sind Ringe ähnlich den Ringen aus S-Atomen bekannt. Am häufigsten werden Ketten mit sehr vielen Se- oder Te-Atomen beobachtet.
![]()


