5.2.6 Temperaturabhängigkeit der Bildung von Mischkristallen und Intermetallischen Phasen
Unsere Fragestellung gilt nach wie vor dem Zusammensetzen von Teilchen. Im Wesentlichen haben wir uns damit befaßt, welche Teilchenarten zu echten Strukturen zusammensetzbar sind. Aber bereits beim Eisen ist uns begegnet, daß sich die Teilchen bei verschiedenen Temperaturen offensichtlich anders anordnen, wenn die Wärmebewegung kleine Kraftwirkungen bei hohen Temperaturen kompensiert. Außerdem sind die Teilchenverbände durch hohen Druck ebenfalls beeinflußbar, verschiedene Gitterkonstruktionen sind möglich.
Insofern ist bei exakter Beschreibung der Substanzen anzugeben, unter welchen Druck- und Temperaturbedingungen sie stabil zusammengesetzt werden können. Aus der Tatsache, daß eine Teilchenkombination bei niedriger Temperatur möglich ist, können wir nicht schließen, daß sie deshalb auch bei hoher Temperatur konstruierbar sein muß und umgekehrt. Ebenso ist es mit den Substanzen bei verschiedenen Drücken: Die Auskunft über die Möglichkeiten des Zusammensetzens von Teilchen bei verschiedenen Temperaturen und Drucken kann wiederum nur das Experiment im Labor geben!
Genau genommen müßte jedes Konzentrationsband, das wir bisher verwendet haben, eine Angabe des Drucks und der Temperatur besitzen, bei denen gemessen worden ist. Das wollen wir jetzt nachholen. Die Betrachtungen bei verschiedenen Drücken soll hier jedoch noch nicht aufgegriffen werden, weil bei den Feststoffen erst Drücke im Kilobar-Bereich eine wesentliche Rolle spielen. Zunächst wollen wir uns damit befassen, welchen Einfluß die Temperatur, die "Schwingungsbewegung" der Teilchen, auf die Bildung von Teilchenverbänden hat.
Begrenzung der Mischkristallbildung durch ungünstiges Atomradienverhältnis und schlechte Bindekräfte. Gold- und Nickel-Atome bauen beide das gleiche kubisch flächenzentrierte Gitter, die Schmelztemperaturen und Oberflächen-spannungen deuten an, daß sich die Ni-Atome untereinander stärker binden als die Au-Atome. Außerdem weichen die Atomradien, auf das kleinere Ni-Atom bezogen, um 14 % ab. Zu erwarten ist also höchstens begrenzte Mischkristallbildung. Das wird durch das Experiment bestätigt: Bei 600°C erhalten wir einen Goldreichen Mischkristall mit 13 Atom% Ni und einen Nickelreichen Kristall mit 95 Atom% Ni, wie es im Konzentrationsband (1) der Abbildung 5.81 zu erkennen ist
Bei Temperaturerhöhung auf 650°C schwingen alle Teilchen stärker, sie benötigen mehr Platz gegenüber dem Zustand bei 600°C, das Material dehnt sich aus. Bei gleich vielen Teilchen und größerem Platzbedarf benehmen sich die Teilchen so, als ob sie größer geworden wären. Wenn nun im Gitter etwas zu große Teilchen eingebaut sind, wie die Au-Atome im Nickel-Mischkristall, dann "passen" die größeren Atome bei stärkerer Schwingung, also bei höherer Temperatur, besser. Das Mischkristallgitter kann deshalb etwas mehr von der großen Teilchensorte ins Gitter einbauen.
Genauso ergeht es den großen Au-Atomen mit den kleinen Ni-Atomen. Bei hoher Temperatur gleichen sich die "Unebenheiten" im Gitter, die durch die kleinen Teilchen verursacht werden, infolge der stärkeren Schwingung immer mehr aus. Der Gold-Mischkristall kann dann ebenfalls bei höherer Temperatur mehr kleine Ni-Atome in sein Gitter einbauen. Bei 650°C erhalten wir daher einen Goldreichen Mischkristall mit 20 Atom% und einen Nickelreichen Mischkristall mit nun mehr 93 Atom% Nickel. Dies ist im Konzentrationsband (2) in Abbildung 5.82 veranschaulicht.
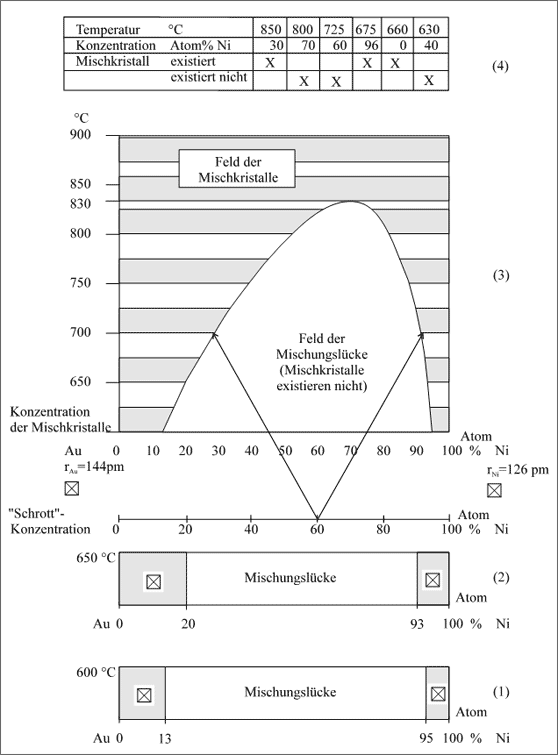
Abbildung 5.82: Mischkristallbildung in Abhängigkeit von der Temperatur, Beispiel Gold - Nickel
So kann man die Messungen fortführen zu immer höheren Temperaturen. Je höher die Temperaturen werden, desto mehr gleichen sich die beiden Atomsorten durch ihr Schwingungsverhalten im Gitter an. Die Homogenitätsbereiche der beiden Mischkristallsorten werden immer größer, die Mischungslücken immer kleiner. Bei 825°C existiert in der Gegend von 70 Atom% Ni noch eine winzige Mischungslücke, bei 830°C ist sie völlig verschwunden. Das heißt, daß bei dieser Temperatur Au- und Ni-Atome in jedem beliebigen Zahlenverhältnis zusammensetzbar sind, was bei niedriger Temperatur nicht möglich ist. Gold und Nickel bilden also ab 830°C eine lückenlose Mischkristallreihe.
In (3) der Abbildung 5.82 sind die bei der jeweiligen Temperatur gemessenen Konzentrationsbänder ihrer Temperatur nach zusammengesetzt. Die Meßpunkte bei verschiedenen Temperaturen sind zu einem Kurvenzug verbunden. Aus diesem Kurvenzug können wir nun jedes Konzentrationsband bei jeder Temperatur entnehmen, bzw. die Information, welche Mischkristalle bei entsprechender Temperatur zusammensetzbar sind und welche nicht. Bezeichnen wir die einzelnen homogenen Mischkristalle allgemein als Phase, dann wird das gesamte Temperatur-Konzentrations-Diagramm "Phasendiagramm" genannt.
Dieses Phasendiagramm beschreibt Temperatur-Konzentrationsfelder, die etwas über die Existenz einer Phase aussagen. In unserem Fall sind es zwei Felder, die durch den Kurvenzug voneinander abgetrennt sind: Im "Feld der Mischungslücke" sind alle Temperatur-Konzentrationspaare abzulesen, bei denen kein Mischkristall existiert. Darüber sind im "Feld der Mischkristalle" die Bedingungen abzulesen, unter denen homogene Phasen existieren. In (4) der Abbildung 5.82 sind einige Übungsbeispiele aufgeführt.
Besonders sei darauf hingewiesen, daß die senkrecht verlaufenden Temperaturachsen, die bei 0 und 100 Atom% beginnen, die Existenzlinien für die reinen Substanzen Gold und Nickel darstellen. Das Existenzfeld für stabile Kristalle schließt also diese senkrechten Achsen für die reinen Substanzen ein.
Gibt man nun ein Teilchenverhältnis in einer Schmelze vor, das in die Mischungslücke fällt, dann werden sich die beiden Grenzkristalle bilden müssen, die bei der entsprechenden Temperatur stabil sind. Ein Beispiel soll diesen Zusammenhang erläutern.
Gold und Nickel werden gedanklich im Atomzahlenverhältnis 40 : 60 in einen Tiegel gegeben: es wird beispielsweise "Gold-Nickel-Schrott" dieser Zusammensetzung geschmolzen. Durch Abkühlen sorgen wir dafür, daß sich die Teilchen zum Mischkristall mit 60 Atom% Ni zusammensetzen und stellen anhand des Diagramms (3) fest, daß er beispielsweise bei 850°C stabil ist. Nun senken wir rasch die Temperatur auf 700°C. Aus dem Diagramm lesen wir ab, daß dieser Kristall in der bestehenden Konzentration bei 700°C nicht existieren kann. Folglich wird im Kristall, der bei 850°C zur Zufriedenheit aller Teilchen stabil ist, ein Gedränge, Geschiebe und Wandern der Atome einsetzen, bis sie durch Diffusion alle solche Plätze erreicht haben, die entweder dem Goldreichen oder dem Kupferreichen Mischkristall bei 700°C entsprechen. Beide Pfeile des Diagramms (3), die von der vorgegebenen "Schrott-Konzentration" von 60 Atom% Ni ausgehen, zeigen auf die entstehenden Mischkristalle: Zum einen sind es solche mit nur 30 Atom% Ni, zum anderen die mit ca. 92 Atom% Ni.
Bringen wir also eine Teilchenkombination aus einem stabilen Existenzbereich gleich welcher Art durch Änderung der Temperatur in einen Bereich, wo diese Teilchenkombination nicht existenzfähig ist, dann findet eine Teilchenumgruppierung statt, eine chemische Reaktion. Es bilden sich bei der neuen Temperatur mögliche, existenzfähige Kristalle.
Schmelzen als Konkurrenz zur lückenlosen Mischkristallreihe bei hohen Temperaturen. Nur die wenigsten Teilchenpaare, die begrenzt Mischkristalle bilden, schließen ihre Mischungslücke bei hohen Temperaturen so schön wie das Paar Au/Ni. Die stärkere Teilchenbewegung bei hohen Temperaturen begünstigt zwar den etwas besseren Einbau der zweiten Teilchensorte, sie beansprucht aber auch die Bindekräfte sehr stark, die die Teilchen zum Gitter zusammenhalten sollen. Insofern entsteht bei Temperaturerhöhung eine Konkurrenz zwischen "besserem Teilcheneinbau" einerseits und "Teilchen herausschwingen" andererseits.
Als typischen Fall dieses Verhaltens stellen wir das bereits bekannte Teilchenpaar Cu/Ag vor. Abbildung 5.83 zeigt in analoger Weise zum vorhergehenden Paar Au/Ni die Schichtung der Konzentrationsbänder bei verschiedenen Temperaturen. Die Bänder sind aber nicht mehr eigens gekennzeichnet, sondern nur die Trennungslinien der Existenzfelder.
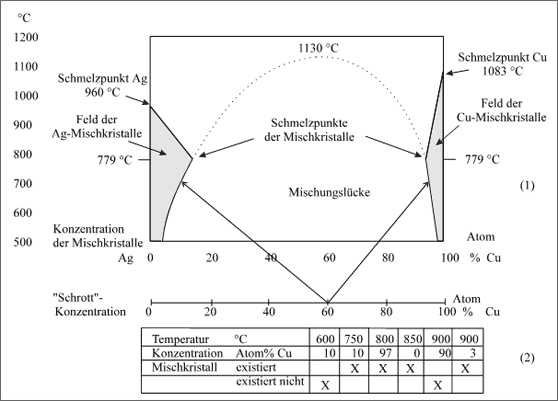
Abbildung 5.83: Mischkristallbildung in Abhängigkeit von der Temperatur, Beispiel Silber/Kupfer
Die Mischkristallbildung ist bei 500°C noch nicht übermäßig, da die Cu/Ag-Bindekräfte schwach sind. Sowohl die Kupferreichen als auch die Silberreichen Mischkristalle nehmen in ihrem Existenzbereich mit der Temperatur zu. Man könnte sich aus dem begonnenen Kurvenverlauf der Mischkristalle von 500°C bis ca. 800°C einen Kurvenzug konstruieren, der bei ca. 1130°C und 60 Atom% Cu die lückenlose Mischkristallbildung erreichen würde (vgl. punktierte Linie der Abb. 5.82).
Die Teilchen spielen aber nicht mit. Die Ag-Atome sind zu schwach an die Cu-Atome gebunden und bereits bei 779°C beginnen die ersten Ag-Atome mit einigen stark schwingenden Cu-Atomen, den Kristall zu verlassen: Es entsteht der erste Tropfen Schmelze. Und nun ist es um den Weiterbau des Mischkristalls geschehen. Gerade die Ag-Atome, die wir mehr und mehr in den Kristall einbauen wollten, verlassen in verstärktem Maße den Kristallverband. Die sich stark bindenden Cu-Atome reichern sich im zurückbleibenden Mischkristall an, der immer mehr an Ag-Atomen verarmt, die Cu-Atome sind immer schwerer aus dem Gitter herauszuschwingen.
Die Schmelztemperatur steigt mit zunehmendem Gehalt an Cu-Atomen laufend an, bis die Schmelztemperatur von reinem Kupfer bei 1083°C erreicht wird. Wie man im Diagramm erkennen kann, liegt die Schmelztemperatur des Kupferreichen Mischkristalls umso niedriger, je höher die Konzentration an Ag-Atomen ist.
Der Silber-Mischkristall mit maximalem Kupfer-Anteil von 14 Atom% beginnt bei 779°C, mit 10 Atom% bei 830°C und mit 5 Atom% bei 890°C zu schmelzen. Es sei nochmals betont, daß sich die Temperaturangaben auf den Schmelzbeginn des Mischkristalls beziehen, denn um den gesamten Mischkristall zu schmelzen, muß man das Temperaturintervall durchlaufen. Dementsprechend ist das Feld der Ag-Mischkristalle von drei Kurven begrenzt, die jeweils verschiedene Bedeutung haben.
Die senkrechte Achse, die 100 % Silber bedeutet, zeigt die Existenz des reinen Silberkristalls bis 960°C an, bei höherer Temperatur ist das Silber geschmolzen. Allerdings betrachten wir in dieser Diskussion nicht die Schmelze, sondern nur die Kristalle. Ausgehend vom Schmelzpunkt des reinen Silbers läuft eine Kurve zum Mischkristall mit maxmaler Konzentration an Kupfer bei 779°C. Alle diese Punkte stellen Schmelztemperaturen verschiedener Mischkristalle dar. Die anschließende Kurve zeigt Mischkristalle entsprechender Konzentrationen an, die in den Konzentrationsbändern registriert sind.
Das Feld der Cu-Mischkristalle ist völlig analog zu verstehen. Es ist nur etwas kleiner mit einer maximalen Konzentration des Mischkristalls von 5 Atom% Ag, der bei der gleichen Temperatur wie der Ag-Mischkristall schmilzt, nämlich bei 779°C.
Das Diagramm ist ebenfalls ein Phasendiagramm und gibt auf die Frage der Existenz einer festen Phase eine Antwort. Wird beispielsweise eine Schmelze mit 20 Atom% Cu angeboten, so erkennt man, daß ein Mischkristall dieser Zusammensetzung nicht existiert. Man liest im Diagramm ab, daß bei 700°C Mischkristalle der Zusammensetzung von etwa 90 Atom% Ag und solche von 4 Atom% Cu entstehen (vgl. Pfeile in (1) der Abb. 5.83). Einige Beispiele zur Existenz von Mischkristallen zeigt außerdem (2).
Das Schmelzen wird in vielen Darstellungen von Diagrammen dadurch angedeutet, daß eine Linie bei 779°C parallel zur Konzentrationsachse gezogen wird. Die Linie soll dann angeben, daß in diesem System unterhalb der angegebenen Temperatur von 779°C nur noch die feste Phase auftritt: eine Ansammlung aus Ag-Mischkristallen und Cu-Mischkristallen.
Das ist für das Auge hilfreich, aber für die Übersicht schwieriger. Denn man kann nicht sofort erkennen, ob die Linie gezeichnet ist, um einen Existenzbereich abzugeben, oder lediglich als Hilfslinie (eine solche ist die gepunktete Kurve). In unserem Diagramm bedeuten die durchgezogenen Linien und Kurven die Grenzen des Existenzbereichs von Kristallen.
Begrenzung der Mischkristallbildung durch Änderung der Gitterstruktur. Das System Fe/Ni besitzt eine Mischungslücke bei tiefen Temperaturen, weil α-Eisen eine andere Struktur besitzt als Nickel. Aus diesem Grund existieren zwei Mischkristallarten (vgl. Abb. 5.84).
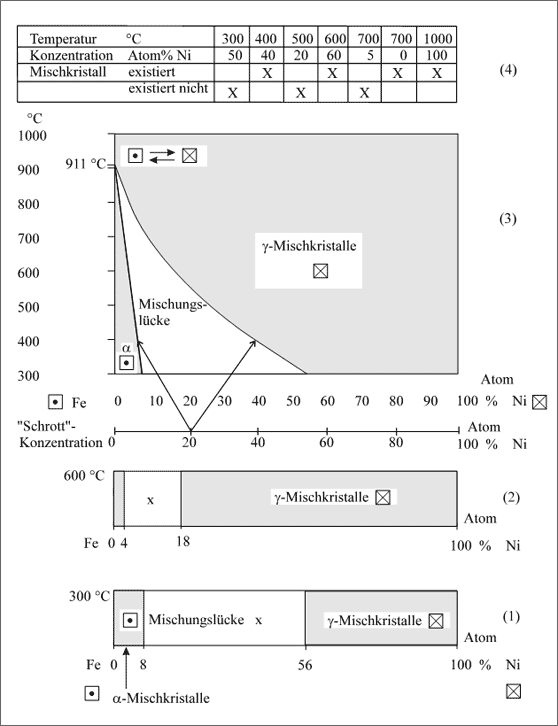
Abbildung 5.84: Mischkristallbildung in Abhängigkeit von der Temperatur, Beispiel Eisen-Nickel
Offensichtlich wird die Mischungslücke mit steigender Temperatur kleiner und verschiebt sich dabei nach links, auf die Seite des Eisens. Das bedeutet, daß mit steigender Temperatur die Bindekräfte der Fe-Atome zur Bildung des kubisch raumzentrierten Gitters immer mehr ins Hintertreffen gelangen und die Ni-Atome die Bildung des kubisch flächenzentrierten Gitters durchsetzen. Bei 911°C sind die Kräfte der Fe-Atome für sich allein durch die Wärmebewegung so herabgemindert, daß der Bau des kubisch raumzentrierten Gitters bei weiterer Temperaturerhöhung nicht mehr möglich ist.
Die Übereinanderschichtung der Konzentrationsbänder zeigt (3) in Abbildung 5.83. Man kann deutlich erkennen, daß mit zunehmender Temperatur der Homogenitätsbereich des Ni-Mischkristalls immer größer wird und ab 911°C eine lückenlose Mischkristallreihe besteht. Der Existenzbereich des α-Eisen-Mischkristalls und die Mischungslücke werden immer kleiner und verschwinden im Punkt 911°C auf der Achse des reinen Eisens. Schmelztemperaturen werden bis zu den angegebenen Temperaturen noch nicht erreicht.
Das Diagramm besteht aus drei Existenzfeldern. Sie informieren uns, ob bei bestimmten Temperaturen und Konzentrationen Fe- und Ni-Atome zu Mischkristallen verknüpfbar sind oder nicht. Denken wir uns etwa einen homogenen Mischkristall aus Fe- und Ni-Atomen der Zusammensetzung 20 Atom% Ni bei 800°C. Kühlt man ihn auf 400°C ab, so scheiden sich bei ungefähr 550°C die beiden Kristallarten ab: es entsteht ein Konglomerat von α- und γ-Mischkristallen (vgl. Pfeile in (3) der Abb. 5.84). Einige Beispiele zur Existenz von Mischkristallen zeigt (4).
Aufgrund der Kenntnis von Phasendiagrammen ist es somit möglich, Reaktionen in dem abgesteckten Rahmen vorauszusagen und zu überblicken. Die diskutierten und ähnliche Betrachtungen an Phasendiagrammen gelten immer, selbst wenn wir in späteren Kapiteln Flüssigkeiten, Dämpfe, Drücke, Dichten und ähnliches mehr in Phasendiagrammen aufnehmen.
Fe/Cr-System. Als letztes Beispiel für ein Phasendiagramm dieser Art sollen Eisen-Chrom-Mischkristalle anhand der Abbildung 5.85 diskutiert werden. Decken wir den unteren Teil des Diagramms von 700°C - 1100°C mit einem Blatt Papier ab, dann ist der sichtbare Teil des Diagramms in der Form vergleichbar mit dem Diagramm des Fe/Ni-Systems (vgl. Abb. 5.84).
Allerdings besitzt das Fe/Cr-System im Gegensatz zum Fe/Ni-System nicht nur oberhalb einer bestimmten Temperatur - hier von 1392°C - eine lückenlose Mischkristallreihe, sondern ebenfalls darunter - hier unterhalb von 800°C. Die Mischungslücke erscheint sehr komplex - sie verrät etwas über die komplizierten Wechselwirkungskräfte zwischen den Fe- und Cr-Atomen.
Bei 1392°C erkennt man den Umwandlungspunkt des γ-Eisens zum δ-Eisen, bei 911°C klappt das γ-Gitter bekanntermaßen in das α-Gitter um. Dazwischen existieren γ-Mischkristalle: sie nehmen maximal 12 Atom% Cr auf. Allerdings setzen die Cr-Atome ihre Bindekräfte so stark ein, daß die γ-Mischkristalle gar bis unterhalb der Umklapptemperatur zum α-Eisen, also unterhalb von 911°C existieren. Ab 15 Atom% Cr können γ-Mischkristalle nicht mehr gebaut werden, die Cr-Atome haben sich mit ihren Bindekräften vollständig zugunsten des Chromgitters durchgesetzt. Beispiele für Meßwertpaare, bei denen Mischkristalle existieren oder nicht, zeigt Tabelle (2) der Abbildung 5.85.
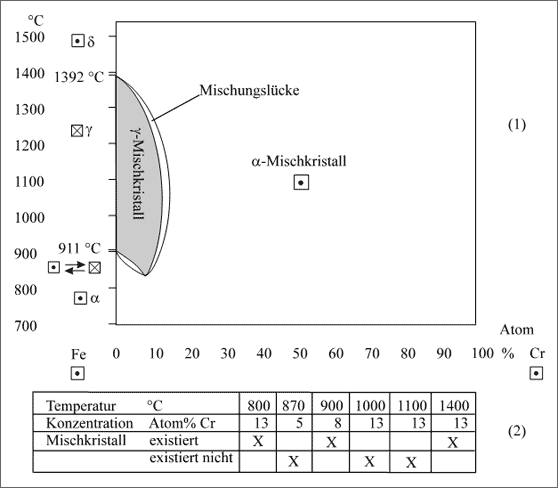
Abbildung 5.85: Mischkristallbildung in Abhängigkeit von der Temperatur, Beispiel Eisen-Chrom
Die Temperaturabhängigkeit der Bildung von Intermetallische Phasen. Die Existenzbereiche der Intermetallischen Phasen ändern sich ebenfalls mit der Temperatur wie die Mischkristalle - wir haben im Prinzip nichts Neues zu erwarten, die Beschreibungsweisen anhand von Phasendiagrammen sind die gleichen.
Fe/V-System. Wir wählen als Beispiel für ein Diagramm, in dem eine Intermetallische Phase vorkommt, das System Eisen/Vanadium und vergleichen zwei Konzentrationsbänder bei 700°C und 1100°C (vgl. (1) und (2) in Abb. 5.87): Der Homogenitätsbereich der *-Mischkristalle wird mit zunehmender Temperatur größer, der Bereich der Intermetallischen Phase kleiner, ebenfalls die Mischungslücke.
Die gesamte Mischungslücke, die die Intermetallische Phase von den α-Mischkristallen abtrennt, zeigt (3) in Abbildung 5.86. Sie wird mit zunehmender Temperatur immer kleiner und ab 1234°C wird über den größten Teil des Konzentrationsbereichs eine Mischkristallreihe möglich, abgesehen von dem kleinen Bereich der γ-Mischkristalle auf der Seite des Eisens. Aber auch dieser verschwindet bei 1392°C.
Insgesamt finden wir im Phasendiagramm bei Temperaturen bis 1400°C also drei Existenzfelder für Kristalle: Kubisch flächenzentrierte γ-Mischkristalle, kubisch raumzentrierte α-Mischkristalle und die Intermetallische Phase FeV. Bei allen Temperatur-Konzentrations-Paaren, die innerhalb oder auf den Grenzlinien der Existenzfelder liegen, sind die entsprechenden Kristalle zusammensetzbar und existenzfähig. Außer den Existenzfeldern finden wir drei Mischungslücken - einige diesbezügliche Beispiele zu Meßwertpaaren zeigt (4) der Abbildung 5.86.
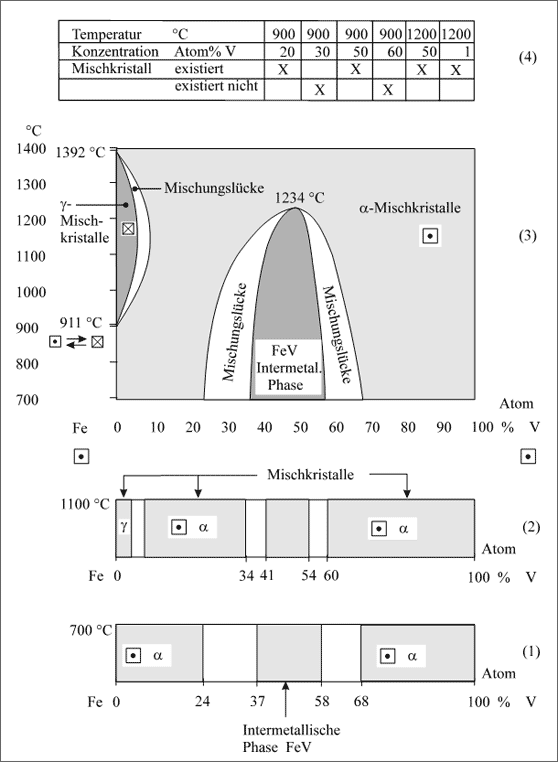
Abbildung 5.86: Mischkristallbildung und Intermetallische Phasen in Abhängigkeit von der Temperatur, Beispiel Eisen/Vanadium
Der Verlauf der großen Mischungslücke zur lückenlosen Mischkristallreihe ist übrigens vergleichbar mit dem Au/Ni-System (vgl. Abb. 5.83) - nur existiert innerhalb dieser Mischungslücke bis zu einer Temperatur von 1234°C die Intermetallische Phase FeV. Ihre Struktur ist allerdings nicht genau bekannt.
Cu/Zn-System. Als weiteres wichtiges Beispiel soll das System Kupfer/Zink dienen, dazu kann das bereits erläuterte Phasendiagramm der Abbildung 5.50 erneut betrachtet und die Abhängigkeit der Existenz von Mischkristallen und Intermetallischer Phase von der Temperatur diskutiert werden. Für das dort abgebildete Diagramm wurde eine Temperatur von 300°C gewählt, zu höheren Temperaturen hin verschieben sich die Homogenitätsfelder etwas, aber nicht übermäßig. Bild (a) der Abbildung 5.87 zeigt sechs Existenzfelder für Kristalle auf.
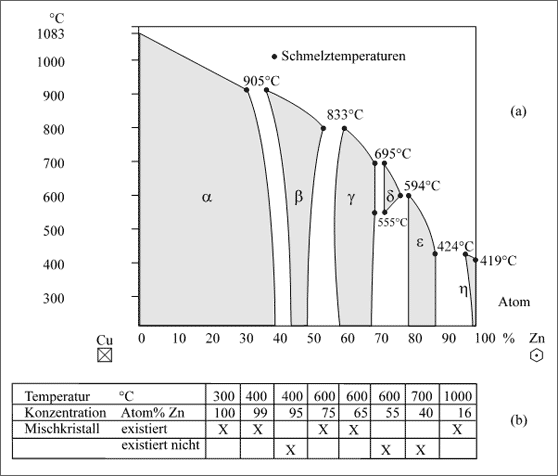
Abbildung 5.87: Mischkristallbildung und Intermetallische Phasen in Abhängigkeit von der Temperatur, Beispiel Kupfer-Zink
Das größte Feld beansprucht der α-Cu-Mischkristall mit kubisch flächenzentriertem Gitter. Zu hohen Temperaturen hin wird die Möglichkeit, Zink-Atome in den Kristall einzubinden, etwas kleiner. Bei einer Temperatur von 905°C schwingen die Teilchen aber bereits aus dem Gitter heraus, der Kristall beginnt zu schmelzen. Die dick ausgezogene Linie bis zum Schmelzpunkt des reinen Kupfers bei 1083°C kennzeichnet die aneinandergereihten Schmelztemperaturen der Mischkristalle mit den entsprechenden Zink-Konzentrationen. Ein Kristall beispielsweise mit 20 Atom% Zn beginnt bei 970°C zu schmelzen. Wenn man mit der Wärmezufuhr beim Erhitzen des Kristalls sehr vorsichtig ist, kann man den Kristall dieser Zusammensetzung bis auf 970°C erwärmen, ohne daß Teilchen den Gitterverband verlassen. Insofern zählen die Bedingungen von Temperatur und Konzentration des möglichen Schmelzens noch zum Existenzbereich unseres Kristalls, die dick ausgezogene Linie ist die Existenzgrenze.
Wir können diese Kurven der "Schmelzbeginn"-Temperaturen als Schmelzkurve der festen Mischkristalle bezeichnen. In späteren Betrachtungen werden wir sie Soliduskurven nennen (lateinisch: solidus = fest). Ganz exakt müßten wir eigentlich "Schmelzbeginnkurve" sagen, weil ja der ganze Kristall nicht bei der einen konstanten Temperatur geschmolzen werden kann. Das ist der Grund, warum man hier einen eigenen Ausdruck "Soliduskurve" gewählt hat.
Das Temperatur-Konzentrations-Feld, in dem α-Mischkristalle existieren können, wird links im Diagramm von der senkrechten Linie für das reine Kupfer begrenzt, die Senkrechte endet bei 1083°C, der Schmelztemperatur. Rechts wird das Feld dann von der Grenzlinie der Mischkristalle mit der maximalen Zink-Konzentration bis zu 40 Atom% Zn begrenzt.
Das Existenzfeld des kubisch raumzentrierten β-Kristalls gruppiert sich um den Bereich von 50 Atom% Zn, es ist das der Intermetallischen Phase: Weder das Cu- noch das Zn-Gitter, sondern eine neue Struktur wird realisiert (vgl. auch Abb. 5.49). Bei Temperaturen über 450°C weicht das Teilchenverhältnis immer stärker vom Verhältnis 1:1 ab, weil die Cu- und Zn-Atome dann statistisch verteilt sind. Das Existenzfeld weitet sich daher zu hohen Temperaturen hin auf, bis die Schmelzpunkte erreicht werden. Die "Schmelzbeginn"-Kurve gibt die Begrenzung des Existenzbereichs zu hohen Temperaturen.
Zu höheren Zink-Konzentrationen schließt sich dann das γ-Feld an. Bis 700°C ändert es seinen Homogenitätsbereich von 10 Atom% kaum, aber bei der maximalen Konzentration von 70 Atom% Zn beginnt die Kristallsorte bereits zu schmelzen. Die "Schmelzbeginnkurve" begrenzt das Existenzfeld der γ-Kristallsorte von 883 bis 695°C.
Zu weiteren Zink-Konzentrationen fortschreitend taucht im Temperaturbereich von 555° bis 695°C ein winziges Existenzfeld der δ-Kristalle auf. Diese Kristallsorte ist uns bisher nicht begegnet, weil sie über dem Temperaturschnitt von 300°C liegt und somit unserer Betrachtung entgangen ist. Hätten wir aber bei unserer Betrachtung zu Beginn den Temperaturschnitt bei 650°C gewählt, dann wäre uns die ε- und η-Phase nicht begegnet. Über die Struktur der δ-Kristalle ist wenig bekannt, die Begrenzung durch die Soliduskurve liegt zwischen 625° und 594°C.
Der folgende Homogenitätsbereich mit steigender Zink-Konzentration der ε-Phase ändert sich kaum mit der Temperatur, die Kristallsorte beginnt bei 424°C zu schmelzen. Der Kupferreiche Kristall dieser Phase schmilzt bei 594°C. Dazwischen liegt die Schmelzbeginnkurve, die den Existenzbereich begrenzt.
Die Zn-Atome im η-Mischkristall bemühen sich mit fortschreitender Temperatur, etwas mehr Cu-Atome in ihrem Gitter zu zügeln. Der vorsichtige Beginn, es dem Au/ Ni-System gleichzutun (vgl. Abb. 5.83) endet aber jäh mit dem Schmelzen bei 424°C.
Zwischen den Existenzbereichen liegen die zu höheren Temperaturen fortgeführten Mischungslücken und ergeben die "Nicht-Existenzfelder" für homogene Kristalle. Sie zeigen uns, in welchem Temperatur-Konzentrations-Bereich wir die Cu- und Zn-Atome nicht zu Kristallen zusammensetzen können. Die Felder der Mischungslücken sind wie beim Ag/ Cu-System (vgl. Abb. 5.84) zu hohen Temperaturen hin geöffnet. Auf jeden Fall finden sich zu höheren Temperaturen hin keine Kristalle mehr, die Teilchen lassen sich unter diesen Bedingungen nicht mehr zusammensetzen. Tabelle (b) der Abbildung 5.87 gibt einige Beispiele zur Existenz von Kristallen an.
Die Vielzahl von Nicht-Existenzfeldern bedingt eine erhebliche Anzahl von Teilchenumgruppierungen, sobald bestimmte Teilchenmengen je nach Konzentrations- und Temperaturbedingungen vorliegen.
Nehmen wir beispielsweise einen α-Mischkristall mit 39 Atom% Zn bei 300°C an - er ist existenzfähig und ändert sich bei den gegebenen Bedingungen nicht. Erwärmen wir ihn aber rasch auf 750°C, dann sind plötzlich durch die zusätzliche Wärmebewegung alle Kräfte zwischen den Teilchen völlig unausgeglichen und der Kristall ist nicht mehr stabil, nicht mehr existenzfähig. Eine große Teilchenwanderung beginnt und es entstehen zwei Kristallsorten: eine bestimmte Menge an α-Mischkristallen mit 36 Atom% Zn und eine andere Menge β-Kristalle mit 42 Atom% Zn. Wenn wir die beiden existierenden Kristallsorten vor und nach dem plötzlichen Erhitzen ver-gleichen, letztlich die Kristallsorten, die aus der ursprünglichen entstanden sind, dann beschreiben wir eine Teilchenumgruppierung. Über diese chemische Reaktion kann mit Hilfe des folgenden Reaktionssymbols informiert werden:
| vorher | nachher |
|||
| Cu/Zn | -----> | Cu/Zn | + | Cu/Zn |
| 61/39 | -----> | 64/36 | + | 58/42 |
| 300°C | 750°C | 750°C | ||
Über die entstandenen Mengen ist in diesem Schema nichts ausgesagt. Die Frage, inwieweit man Reaktionen in solchen Reaktionssymbolen ausdrücken kann, hängt von der Phantasie desjenigen ab, der informieren will, und von den Kenntnissen desjenigen, der die Information aufnehmen soll.
Derjenige, der die vorhergehenden Zeilen gelesen hat und das Cu/ Zn-Phasendiagramm vor sich hat, sollte folgendes Reaktionssymbol als Information verwerten können:
| vorher | nachher |
|||
| Cu/Zn | -----> | Cu/Zn | + | Cu/Zn |
| 55/45 | -----> | 60/40 | + | 53/47 |
| 800°C | 300°C | 300°C | ||
Der Leser soll sich aufgrund dieser Information ein ungefähres Bild machen können,
1. was der Experimentator im Labor prinzipiell getan hat,
2. wie sich die Teilchen prinzipiell umgruppiert haben.
Al/Sb-System. Die Temperaturabhängigkeit eines Teilchenpaares, das ausschließlich eine Intermetallische Verbindung bildet, soll am Beispiel Aluminium/Antimon dargestellt werden. Unserer Absprache nach hat eine Intermetallische Verbindung keinen breiten Homogenitätsbereich, sondern eine konstante Zusammensetzung, die auch unabhängig von der Temperatur erhalten bleibt: Im Temperatur-Konzentrations-Diagramm stellt sich der Existenzbereich der Intermetallischen Verbindung deshalb durch eine senkrechte Strecke dar. In unserem Fall reicht diese Senkrechte bis zur Schmelztemperatur von 1070°C, sie verläuft bei 50 Atom% Sb, dementspre-chend lautet die Formel für die Intermetallische Verbindung also AlSb (vgl. (a) in Abb. 5.89).
Da sich die Al- und Sb-Atome nicht zu Mischkristallen zusammensetzen lassen, treten im Diagramm keine solchen Existenzfelder auf, sondern neben der AlSb-Linie nur Existenzlinien von reinem Aluminium und reinem Antimon. Wird eine Schmelze aus 50 Atom% Sb abgekühlt, so erstarrt sie zur Intermetallischen Verbindung AlSb. Liegt eine andere Zusammensetzung vor, so entsteht die Verbindung AlSb ebenfalls, es bleibt allerdings auch der Legierungspartner zurück, der im Überschuß vorhanden ist.
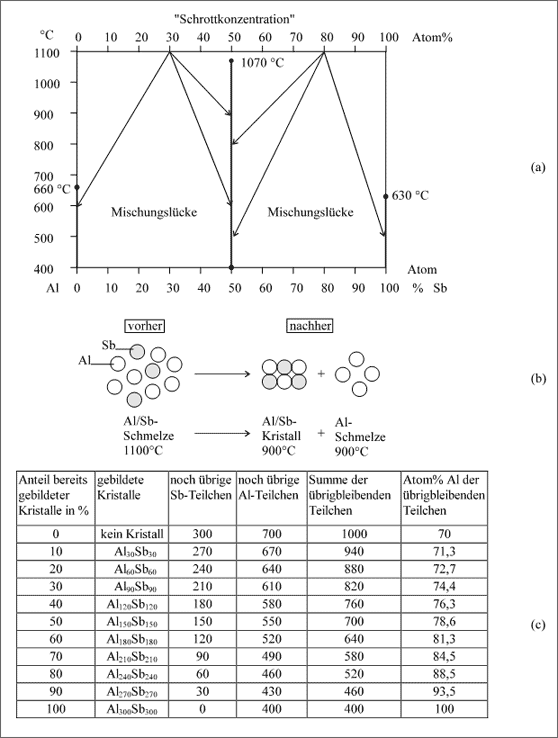
Abbildung 5.88: Intermetallische Verbindung AlSb in Abhängigkeit von der Temperatur, Modellvorstellungen zum Abkühlen einer Aluminium-Antimon-Schmelze
Ein praktisches Beispiel bildet eine Schmelze mit 70 Atom% Al und 30 Atom% Sb. Die Teilchen sind in der Schmelze frei beweglich und verfügbar. Die homogene Schmelze soll eine Temperatur von 1100°C besitzen. Wir erzwingen ein Zusam-mensetzen der Teilchen durch Wärmeentzug und Absenken der Temperatur auf 900°C. Die Teilchenkombination der vorgegebenen Konzentration von 30 Atom% Sb ist bei 900°C nicht existenzfähig, allerdings existiert bei 900°C bereits die Intermetallische Verbindung. Infolge der angegebenen Temperatursenkung und der damit verbundenen Abnahme der Wärmebewegung sind die Al und Sb Atome mit ihren gegenseitigen starken Bindekräften bereits in der Lage, sich zum Kristall AlSb zusammenzusetzen.
Die Bindekräfte der übrig bleibenden Al-Atome reichen aber noch nicht aus, sich zu einem Kristall zusammenzusetzen: neben dem AlSb-Kristall bleibt Aluminiumschmelze übrig. Im Endeffekt bleiben von 100 Teilchen (30 Sb-Atome und 70 Al-Atome) immer 40 Al-Atome übrig (vgl. (b) in Abb. 5.88). Die Al-Atome setzen sich zu Aluminiumkristallen zusammen, wenn die Schmelztemperatur von 660°C unterschritten wird. Solche Reaktionen können wiederum mit Reaktionssymbolen veranschaulicht werden:
| vorher | nachher |
|||
| A1/Sb | -----> | A1Sb | + | A1 |
| 70/30 | -----> | 50/50 | + | |
| 1100°C | 900°C | 900°C | ||
| Schmelze | Kristall | Schmelze | ||
| oder: | A1Sb | + | A1 | |
| 600°C | 600°C | |||
| Kristall | Kristall | |||
Verfolgen wir das Übrigbleiben der Al-Atome, wenn wir mit 1000 Teilchen (700 Al- und 300 Sb-Atomen) beginnen und jeweils 30 Al- und 30 Sb-Atome gedanklich zu einem Kristall zusammensetzen (vgl. (c) in Abb. 5.88). In zehn Schritten sind wir dann mit dem Bauen des Kristalls fertig, denn mehr als 300 Sb Atome stehen uns für den Bau von Kristallen nicht zur Verfügung, 400 Al-Atome bleiben bei einer Temperatur von 900°C als Schmelze übrig (b). Obwohl dies in der Praxis nicht exakt durchführbar ist, wollen wir dieses Schema als Grundüberlegung so stehen lassen. Genauere Überlegungen und Beschreibungen werden wir bei der Betrachtung der "Schmelzgleichgewichte" kennenlernen.
Zn/Pb-System. Betrachten wir als letztes Beispiel und Extremfall das System Zink/Blei, das wir bereits kennengelernt haben (vgl. Abb. 5.40). Die Teilchen verknüpfen sich weder zu Mischkristallen, noch zu Intermetallischen Verbindungen: das Konzentrationsband besteht letztlich nur aus einer einzigen Mischungslücke. Bei anderen Temperaturen verändern sich die Verhältnisse nicht, so daß das Phasendiagramm für die festen Kristalle nur aus den beiden Existenzstrichen der reinen Metalle besteht (vgl. Abb. 5.89).
Das System Zn/Pb verhält sich vergleichbar den Paaren Al/ AlSb und Sb/ AlSb, die jeweils die Hälfte des Diagramms (a) der Abbildung 5.88 darstellen. Welches Teilchenangebot an Zn- oder Pb-Atomen auch gemacht wird, es setzen sich immer nur entweder Zn- oder nur Pb-Atome zusammen. Gibt man beispielsweise die Konzentration 60 Atom% Pb in einer Schmelze vor und senkt die Temperatur auf 400°C, dann setzen sich nur Pb-Atome zusammen und es scheiden sich Bleikristalle ab, die Zn-Atome bleiben frei beweglich. Wird die Temperatur bis 200°C erniedrigt, dann setzen sich alle Pb- Atome zu Bleikristallen und alle Zn-Atome zu Zinkkristallen zusammen. Auch hier lassen sich dazu Reaktionssymbole formulieren:
| vorher | nachher |
|||
| Pb/Zn | -----> | Pb | + | Zn |
| 600°C | 400°C | + | 400°C | |
| Schmelze | Kristall | Schmelze | ||
| Pb/Zn | -----> | Pb | + | Zn |
| 600°C | 200°C | 200°C | ||
| Schmelze | Kristall | Kristall | ||
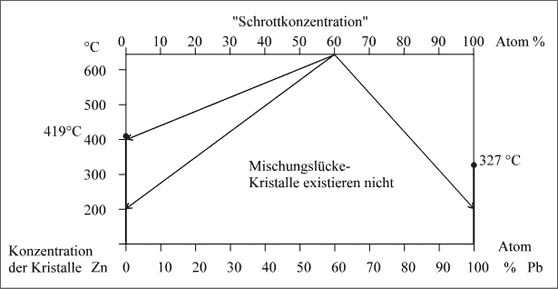
Abbildung 5.89: Vollständige Mischungslücke, unabhängig von der Temperatur, Beispiel Zink-Blei
Ein praktisches Beispiel bildet eine Schmelze mit 70 Atom% Al und 30 Atom% Sb. Die Teilchen sind in der Schmelze frei beweglich und verfügbar. Die homogene Schmelze soll eine Temperatur von 1100°C besitzen. Wir erzwingen ein Zusam-mensetzen der Teilchen durch Wärmeentzug und Absenken der Temperatur auf 900°C. Die Teilchenkombination der vorgegebenen Konzentration von 30 Atom% Sb ist bei 900°C nicht existenzfähig, allerdings existiert bei 900°C bereits die Intermetallische Verbindung. Infolge der angegebenen Temperatursenkung und der damit verbundenen Abnahme der Wärmebewegung sind die Al und Sb Atome mit ihren gegenseitigen starken Bindekräften bereits in der Lage, sich zum Kristall AlSb zusammenzusetzen.
Lieber Leser, liebe Leserin, dieses war der zweite Streich, doch der dritte folgt sogleich !
Alle die diskutierten Erscheinungen der Temperatur-Konzentrations-Abhängigkeit bei der Bildung von Mischkristallen und Intermetallischen Phasen gelten letzten Endes ganz allgemein, auch wenn die Kristalle nicht aus Metall-Atomen zusammengesetzt sind. Die Beschreibungsweisen anhand der Diagramme sind allgemein anwendbar, die Felder der Existenz und Nicht-Existenz von Kristallen und anderen Phasen treten immer wieder auf und lassen Rückschlüsse auf Reaktionsabläufe zu. Wir werden bei den Molekül-Kristallen im Band 3 und bei den Ionen-Kristallen im Band 4 wieder auf diese Grundgedanken zurückgreifen.
![]()


