5.1.10 Allgemeine Eigenschaften der Metalle
Der Begriff Metall ist sehr weitläufig und nicht exakt faßbar, in der Praxis gelten folgende Aussagen für Metalle: Im allgemeinen leiten sie den elektrischen Strom und die Wärme gut, sie besitzen metallischen Glanz und sind meistens plastisch verformbar. Jeder Schmied und jedes Walzwerk nutzen diese Verformbarkeit aus, genau wie jeder, der ein Stück Blech oder Draht verbiegt oder eine Niete breitschlägt.
Diese Verformbarkeit beruht in erster Linie darauf, daß die Metall-Atome in einer dichtesten Packung nicht direkt voneinander getrennt werden müssen, um ihre Lage zu ändern. Modellmäßig gesehen genügt das Hinausheben aus einer Kugelmulde, nach kleiner Verschiebung kann die Kugel erneut in eine andere Mulde einrasten, und liegt im gleichen Bindungszustand vor wie vorher (vgl. (1) in Abb. 5.21). Diese Verschiebung funktioniert bei ganzen Kugelreihen und Flächen (2).
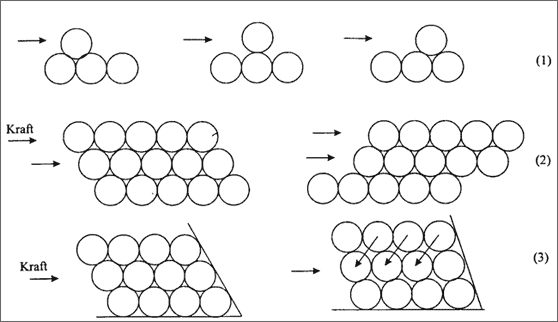
Abbildung 5.21: Modellvorstellungen zur Verformung von Metallen
Leichte Verschiebbarkeit der Kugeln ist dann gewährleistet, wenn gleitfähige Kugelebenen vorhanden sind, also in den Lücken keine anderen Teilchen als "Bremsklotz" wirken und das Gleiten verhindern. Da wegen der großen Symmetrie in der kubisch dichtesten Kugelpackung die meisten Gleitebenen zu finden sind, ist eine Substanz dieser Struktur auch am leichtesten zu verformen wie etwa Gold oder Blei.
Wenn die Ebenen zum Gleiten blockiert sind, lassen sich die Metall-Atome bei Krafteinwirkung meistens ein wenig aus ihrer Ruhelage zerren, nicht aber sofort verschieben (vgl. (3) in Abb. 5.21). Hört die Krafteinwirkung auf, ziehen die Bindekräfte die Atome wieder in ihre Ausgangspositionen zurück: Das Material ist elastisch, wie wir es von jeder Eisenstange her kennen. In üblichen Metallstücken sind allerdings Packungsfehler vorhanden und meistens keine fehlerfreien Kugelpackungen realisiert. Wenn es gelingt, die dichteste Packung tatsächlich bis zur sichtbaren Kristallgröße fehlerfrei aufzubauen, dann bezeichnen wir diesen Kristall als Einkristall.
Wie wir am Elementarwürfel der kubisch dichtesten Kugelpackung diskutiert haben, ist die Teilchenabfolge nicht in jeder Richtung gleich: In einer Richtung sind es Quadratmaschen, in der anWie wir am Elementarwürfel der kubisch dichtesten Kugelpackung diskutiert haben, ist die Teilchenabfolge nicht in jeder Richtung gleich: In einer Richtung sind es Qua-dratmaschen, in der anderen Richtung dichtest gepackte Dreiecksmaschen. Das fuhrt tatsächlich dazu, daß die physikalischen Eigenschaften an einem Einkristall. nicht an jeder Stelle gleich, sondern richtungsabhängig sind. Diese Erscheinung läßt sich mit der Bearbeitung eines Holzbretts vergleichen: das Sägen oder Spalten des Bretts mit der Maserung und gegen die Maserung unterscheiden sich drastisch.
Wenn wir die elektrische Leitfähigkeit an einem Einkristall messen, kann es sein, daß sie in - einer Richtung gut ist, in der Senkrechten dazu schwächer. Die gleiche Erscheinung beobachtet man auch am Licht. Es gibt Einkristalle (keine Metallkristalle ), durch die ein Lichtstrahl in einer Richtung normal hindurchgeht, in einer anderen Richtung dagegen als doppelter Lichtstrahl herauskommt. Bei einem Kristall ist es daher häufig notwendig, bei Angabe der physikalischen Eigenschaften die Richtung des Kristalls mit zu benennen, in der gemessen worden ist. Diese Richtungsabhängigkeit von Eigenschaften eines Kristalls nennt man Anisotropie, er ist anisotrop. Besitzt ein Kristall in allen Richtungen die gleichen Eigenschaften, wird er isotrop genannt.
Nun sind die meisten Materialien keine Einkristalle, sondern bestehen aus vielen "zusammengebackenen" Einkristallen. Ein Stück Kandiszucker ist ein Einkristall, ebenso wie die kleinen Zuckerkriställchen des Speisezuckers. Wenn Speisezucker feucht geworden ist, verkleben die Kriställchen untereinander zu einem Zuckerklotz, an dem die einzelnen Kriställchen aber noch gut zu beobachten sind. Das Gleiche gilt fur das Speisesalz. Jedes kleine Salzkörnchen ist fur sich ein würfeliger Einkristall. Leicht feucht geworden, vereinigen sich Einkriställchen zu einem Salzblock, in dem aber die kleinen Kristallite noch gut erkennbar sind.
Bei den Metallen ist dies ebenso. Viele kleine Einkristalle lagern sich zu großen Metallblöcken zusammen, wobei die einzelnen Kristalle, beispielsweise auf einem frisch verzinkten Blech, wie Eisblumen schön zu erkennen sind. Bei üblichen Metallstücken kann man Einkristalle deutlich nur im Mikroskop sehen.
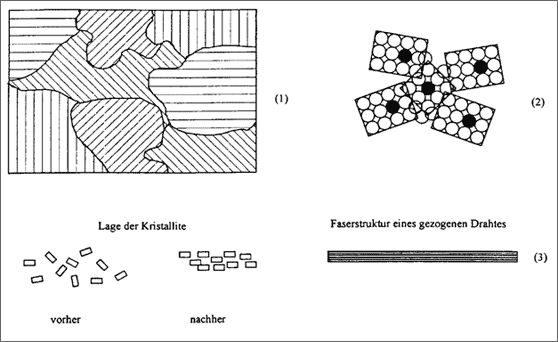
Abbildung 5.22: Metallkristallite und Modellvorstellungen
Modellvorstellungen können das erläutern (vgl. (1) und (2) in Abb. 5.22): Die als schwarze Kugeln markierten Teilchen lagern gleichzeitig andere Teilchen an, alle nach dem gleichen Baumuster. Damit wachsen die Kristalle in die verschiedenen Richtungen, bis sie an die Nachbarkristalle anstoßen und - so gut es geht - die bleibenden Lücken schließen.
Die kleinen Kristalle nennt man Kristallite oder "Korn". Die Nahtstellen werden auch als Korngrenzen bezeichnet. An diesen Stellen reißt ein Material bei Zugbeanspruchung am leichtesten, weil in den Randzonen die Kriställchen fehlerhaft zusammengebaut sind. Im Gegensatz zu einem Einkristall nennt man solch ein Material polykristallin.
Die Eigenschaften eines Materials, z. B. eines Silberdrahtes, hängen nun nicht nur von der Bauweise des Gitters der Kristalle ab, sondern auch von der Größe und Lage der Kristallite, dem Gefüge. Bei hoher Temperatur besitzen die Teilchen mehr Bewegung und können auch im festen Zustand ab und zu ihren Platz ändern. Sie lagern sich dann auf Dauer an immer bessere Plätze anderer Kristalle, so daß die kleinen verschwinden, die großen Einkristalle größer werden. Die Kristallite wachsen, das Korn wird größer, die Materialeigenschaften ändern sich.
Diese Änderung von Materialeigenschaften ist sehr gut erkennbar, wenn wir beispielsweise Kupfer zu Draht ziehen. Dazu wird ein Stück polykristallines Kupfer gleichsam durch ein Loch gepreßt und der Kupferdraht weggezogen. Dabei wird das Material sehr stark gestreckt: Die Kristallite, die vorher kreuz und quer lagen, werden in eine Richtung gelagert und ergeben eine Art Faserstruktur der Kristallite (v gl. (3) in Abb. 5.22).
Dieser Draht ist elastisch wie Stahl, weil die Kristallite alle gegenseitig etwas verspannt sind, die Kupfer-Atome sitzen nicht mehr alle in ihren richtigen Mulden und ziehen kräftig dorthin zurück. Glüht man diesen Draht kurze Zeit, dann wechseln die Atome ihre Plätze, bilden größere und in allen Richtungen liegende Kristallite: Das Material wird rekristallisiert. Dabei ist der Draht weich und brüchig geworden. Die Kupfer-Atome sind dieselben, die Art des kubisch flächenzentrierten Gitters ist dasselbe, aber die Kristallite und das Gefuge haben sich geändert, damit auch die Eigenschaften des Materials.
Eine ganze Reihe von Eigenschaften reiner Metalle lassen darauf schließen, daß die ungerichteten Anziehungskräfte, die Bindungskräfte zwischen den einzelnen Atomen, von Atomsorte zu Atomsorte verschieden sind. Die Bindungskraft zwischen zwei Zink-Atomen in einem Zinkkristall muß z. B. kleiner sein als die Bindungskraft von Gold- zu Gold-Atom in einem Goldkristall. Solche Rückschlüsse lassen sich unter anderem aus der Härte, der Schmelztemperatur des Metalls und der Oberflächenspannung der Metallschmelze ziehen.
Härte. Als Härte bezeichnen wir den Widerstand, den ein Werkstoff dem Eindringen eines Prüfkörpers entgegensetzt. Es gibt verschiedene Meßverfahren, die die Härteeigenschaft der Materialien unterschiedlich beschreiben, ähnlich, wie es mehrere Methoden zur Temperaturmessung gibt. Das einfachste Verfahren ist eines, bei dem man feststellt, welches Material sich durch ein anderes ritzen läßt.

Tabelle 5.4: Härteskalen nach Mohs und Vickers
Das Ritzmaterial ist immer härter als das geritzte Material. Die zehn dazu ausgewählten Mineralien bilden die mineralogische Härteskala nach Mohs. Tabelle 5.4 zeigt diese Skala und im Vergleich dazu diejenige nach Vickers: ihr liegen technische Materialien verschiedener Härte zugrunde.
Das Meßverfahren nach Vickers liefert genauere Werte und beruht darauf, die Spitze einer kleinen quadratischen Pyramide aus Diamant in das Material zu drükken, wobei als Eindruck ein kleines Quadrat an der Oberfläche hinterbleibt (vgl. (1) in Abb. 5.23). Je kleiner der Eindruck bei gleichem Kraftaufwand ist, desto größer ist die Härte des Materials. Entscheidend bei dem Härteprüfverfahren ist aber, daß beim Eindringen der Spitze in ein Metall die Atome mechanisch voneinander getrennt werden müssen, dabei verschieben sich auch gleichzeitig ganze Ebenen von Teilchen. Die dem Eindringen entgegenwirkende Kraft wird also durch die Bindekräfte der Teilchen verursacht: Je stärker die Atome aneinander gebunden sind, desto härter ist demnach ein Metall .
Dieser Vergleich trifft in erster Linie aber nur fur gleich große Atomsorten zu: je größer die Atome sind, desto weniger Atome müssen vom eindringenden Keil bei gleicher Eindringtiefe auseinandergetrennt werden (vgl. (2) in Abb. 5.23). Viele kleine Atome mit schwacher Bindekraft und schlechter Verschiebbarkeit der Schichten können daher den gleichen Aufwand zum Trennen erfordern, wie wenige große Atome mit starker Bindekraft. Da die Metall-Atome der gängigen Metalle allerdings ähnlich groß sind, liefert die Härte doch einen guten Hinweis auf die Größe der Bindekräfte zwischen den Atomen in einzelnen Metallen (vgl. Tab. 5.5).
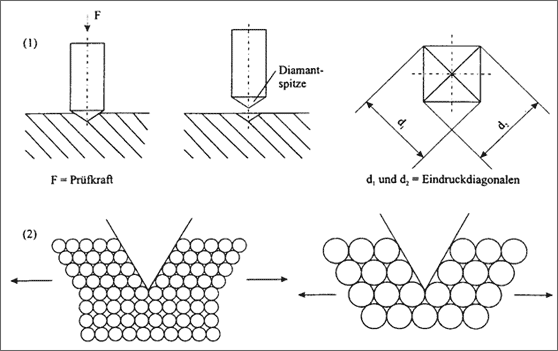
Abbildung 5.23: Härtemessung eines MetaIls nach Vickers (F = Prüfkraft, d = Eindruckdiagonale) ModeIlvorsteIlungen zum Härteprüfverfahren
Schmelztemperatur. Wie bereits in anderem Zusammenhang dargelegt, fUhren die Metall-Atome auf ihren Gitterplätzen schwingende Bewegungen aus, wobei die Temperatur ein Maß für die Heftigkeit der Teilchenbewegungen darstellt. Dabei bewegen sich die Atome im Anziehungsbereich ihrer Nachbaratome. Bei zuneh-mender Schwingungsintensität, eine Folge zunehmender Temperatur, werden die Kräfte während des Auseinanderschwingens irgendwann so groß, daß die Teilchen von den anziehenden Kräften der Nachbarn nicht mehr festgehalten werden kön-nen. Wenn immer mehr Teilchen aus dem Gitterverband "herausgeschwungen" werden, zerfällt der Gitterverband (vgl. Abb. 5.24): Wir nehmen diesen Vorgang als Schmelzen bei einer bestimmten Schmelztemperatur wahr.
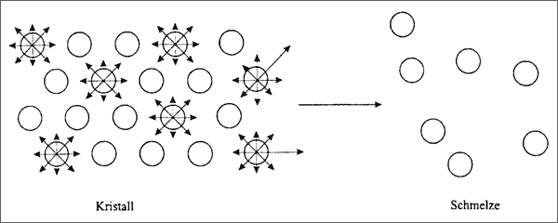
Abbildung 5.24: ModeIlvorstellungen vom Schmelzvorgang
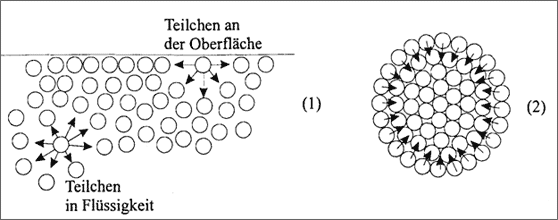
Abbildung 5.25: Modellvorstellungen zur Oberflächenspannung
Wenn nun die Atome schwach aneinander gebunden sind, werden sie bereits bei einem mäßigen Schwingungszustand den Teilchenverband verlassen, das Metall wird bereits bei niedriger Temperatur schmelzen. Besitzen die Teilchen aber große Bindekräfte, dann müssen sie stark in Schwingungen versetzt werden, um den Gitterverband zu "zerschwingen" , das Metall schmilzt bei hoher Temperatur. Insofern gibt die Schmelztemperatur eines Metalls Hinweise auf die Stärke der Bindekräfte zwischen den Atomen. Schmelztemperaturen von einigen Metallen sind in Tabelle 5.5 aufgeführt.
Oberflächenspannung. In einer Schmelze haben die Teilchen keinen festen Platz mehr: sie bewegen sich zwar dicht gedrängt, aber frei im Raum. Sie besitzen jedoch noch ihre gesamten Bindungskräfte, die auf die umgebenden Teilchen stark einwirken. Die Bindekräfte sind allerdings nicht gleich verteilt, kräftemäßig sind die Teilchen im Inneren der Schmelze anders beansprucht, als an der Oberfläche (vgl. (1) in Abb. 5.25). Das markierte Teilchen im Inneren der Schmelze wirkt mit seinen Bindekräften gleichmäßig auf seine zufällig anwesenden Nachbarn, die sehr schnell und ständig wechseln. Andererseits wird das markierte Teilchen im Inneren von allen Seiten nach wie vor gleichmäßig von seinen zufälligen Nachbarn angezogen, auch wenn es innerhalb der Schmelze verschoben wird.
Bei einem Teilchen an der Oberfläche ist das anders. Es wirken zwar von seinen linken und rechten Nachbarn gleichmäßig starke Anziehungskräfte, die Teilchen unterhalb der Oberflächenschicht ziehen das Teilchen aber ins Innere der Schmelze. Würde man ein Teilchen aus seiner Oberflächenschicht etwas herausziehen und loslassen, dann würde es wie von einer Feder gezogen wieder auf die Oberfläche zurückschnellen. Die Oberflächenschicht wirkt somit wie eine einhüllende Haut, die eine Kraftwirkung von der Oberfläche senkrecht nach innen besitzt.
Solange keine weiteren Kräfte, wie beispielsweise die Schwerkraft, auf die Schmelze wirken, hat das zur Folge, daß sich eine Schmelze eigentlich immer zur Kugel formt: alle äußeren Teilchen werden von den inneren Teilchen allseitig nach innen gezogen (vgl. (2) in Abb. 5.25). Das beobachten wir am Quecksilber und an allen flüssigen Metalltropfen, wie sie beim Schweißen, Gießen und Löten oftmals entstehen. Außerdem ist eine kleine Oberfläche einer Metallschmelze immer stark und sichtbar in Richtung der Oberfläche gekrümmt. Die Kräfte, die die Teilchen der Oberfläche nach innen zur Flüssigkeit zusammenhalten, werden als Oberflächenspannung bezeichnet. Sie nimmt bei einer Teilchensorte mit steigender Temperatur ab, weil eine die Teilchen trennende Bewegung mit steigender Temperatur zunimmt.
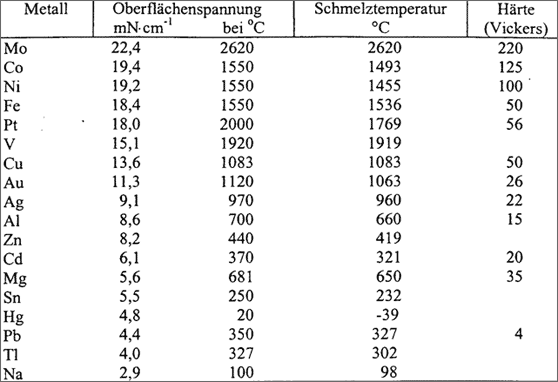
Tabelle 5.5: Meßwerte zu Eigenschaften einiger Metalle
Denken wir uns, daß im Extremfall die Atome eines Metalls keine gegenseitigen Bindungskräfte besitzen würden. Dann würde sich kein Tropfen bilden, sondern alle Atome würden sich als einatomige Lage ausbreiten wie Tischtennisbälle auf einem Tisch. Dann ließe sich auch keine Oberflächenspannung feststellen.
Je größer nun die Bindekräfte zwischen den einzelnen Metall-Atomen sind, desto größer wird auch die Oberflächenspannung sein und umgekehrt. Insofern erhalten wir aus den Werten der Oberflächenspannungen von Metallen ebenfalls Hinweise auf die Bindungskräfte der einzelnen Metall-Atome untereinander. Einige Werte sind in Tabelle 5.5 angegeben.
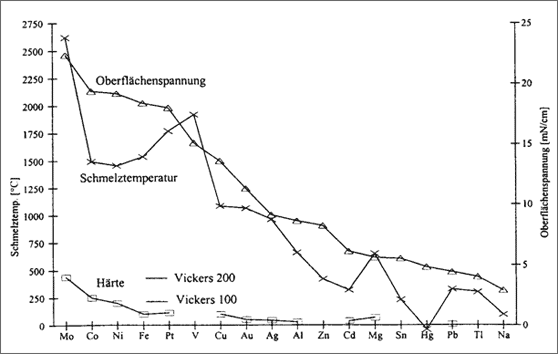
Abbildung 5.26: Tendenzen von Metalleigenschaften gemäß Tabelle 5.5
Trotz intensiver Bemühungen der Kristallphysiker ist eine genaue Beschreibung der Größe der Bindungskräfte von Metall-Atomen bisher nicht gelungen, man kann nur Tendenzen abschätzen. Diese sind in Abbildung 5.26 veranschaulicht, in der die Werte der Tabelle 5.5 vergleichend eingetragen sind. Ordnende Größe ist die Oberflächenspannung: diesbezügliche Werte wurden der Größe nach eingetragen, dann die Härten und Schmelztemperaturen zugeordnet. Offensichtlich erscheinen - je nach Betrachtungsweise - die Schmelztemperaturen von Platin und Vanadium zu hoch, oder von Cobalt, Nickel und Eisen zu niedrig. Ebenfalls fügen sich Magnesium, Blei und Thallium nicht problemlos in diese Darstellung. Ein Zusammenhang zwischen den drei Größen ist jedoch ersichtlich, eine Abschätzung von großen und kleinen Bindekräften der Metall-Atome ist möglich: Im Molybdänkristall werden sicherlich die Bindekräfte größer sein als im Zinkkristall.
![]()


