4.2 Kopplungsregeln anhand des Periodensystems
Jetzt steht unmittelbar die Frage an, an welcher Stelle im Periodensystem
die einzelnen Teilchen mit ihren Teilchen- und Bindungsqualitäten
anzutreffen sind. Damit wir uns für diesen Zweck im Periodensystem
gut orientieren können, trennen wir dieses in zwei Teile, links
und rechts. (vgl. Abb. 2.1)
Wir beginnen die Grenzziehung von oben nach unten, beginnend mit Beryllium
(Be) und Bor (B), setzen die Linie schräg nach rechts unten über
Silicium (Si) in der 3. Periode und Germanium (Ge) in der 4. Periode
fort. Der weitere Verlauf der Trennlinie führt uns schräg
nach rechts unten zum Antimon (Sb) in der 5. Periode und wieder senkrecht
nach unten zum Bismuth (Bi) in der 6. Periode. Diese eigenwillige Trennungslinie
wird durch die Laborergebnisse diktiert.
Von den genannten 103 Elementsorten fallen damit 77 Sorten in den linken
Teil des Periodensystems, es sind die Metalle. Im rechten Teil sind
22 Teilchensorten angesiedelt, die keine Metalle sind, man nennt sie
deshalb Nichtmetalle. Vier Teilchensorten liegen auf der Grenze, es
sind "Zwitter", die weder zu den Metall-Teilchen noch zu
den Nichtmetall-Teilchen gezählt werden oder beides darstellen.
Wir können jetzt drei einfache Regeln zum Verknüpfen von
Teilchen aufstellen, die Tabelle 4.2 in einer schematischen Kurzfassung
zeigt:
1. Wenn wir im linken Teil des Periodensystems Teilchen miteinander
verbinden wollen, dann müssen wir die Atome wählen und räumlich
ungerichtet verknüpfen.
2. Bei Teilchen aus dem rechten Teil wählen wir die Atome und
verknüpfen sie räumlich gerichtet.
3. Die Kombination von Teilchen der linken Seite mit Teilchen der rechten
Seite verlangt, die entsprechenden Ionen räumlich ungerichtet
zu verknüpfen.
Einige Beispiele sollen diese Regeln erläutern: Wenn wir nur Mg-Teilchen
untereinander verbinden wollen, gilt Regel 1. Alle Teilchen stehen
im Periodensystem links. Wir müssen demnach Mg-Atome mit räumlich
ungerichteter Bindefähigkeit miteinander verknüpfen. Ebenfalls
links zu finden sind Cu- und Zn-Teilchen. Beim Kombinieren zu Messing
werden Cu-Atome und Zn-Atome räumlich ungerichtet miteinander
verbunden.
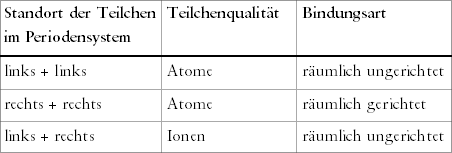
Tab. 4.2: Kombinations-möglichkeiten von Teilchen und Bindungsarten
Wenn wir nun S-Atome miteinander verbinden wollen, dann finden wir
diese rechts im Periodensystem: hier gilt Regel 2, S-Atome werden
räumlich gerichtet miteinander verknüpft. Genau das gleiche
gilt, wenn wir P- und O-Atome verbinden.
Wenn wir Ionen zusammensetzen wollen, müssen wir immer mindestens
zwei Sorten verwenden, denn wir brauchen Kationen und Anionen, also
etwa Mg2+-Ionen und Br--Ionen. Sie werden räumlich ungerichtet
miteinander verknüpft, ebenso Ca2+- und O2--Ionen oder Na+-
und Cl--Ionen.
In den Kapiteln 5 werden die wichtigsten Konstruktionen, die sich
aus diesen drei Grundregeln ergeben, erläutert.
Ein Hinweis zur Stellung des Wasserstoffs im Periodensystem: Es gibt
viele Darstellungen, in denen der jeweilige Autor das H-Teilchen
an den Anfang der ersten Hauptgruppe setzt. Einige wenige Gründe
sprechen dafür, das zu tun. Aber der Wasserstoff ist ein typisches
Nichtmetall, H-Atome bilden gerichtete Bindefähigkeiten aus
und die zugehörigen Ionen sind Hydrid-Ionen (H-), die mit positiv
geladenen Ionen gekoppelt werden können: Insofern gehört
der Wasserstoff auf die rechte Seite des Periodensystems, hier fügt
er sich am besten in das vorliegende Kombinationssystem ein.
![]()


