3.5 Stärke und Normung bei räumlich gerichteter Bindefähigkeit
3.5.1 Normung und Bindungsgrad
Unser Ziel ist es, eine Kombinationsregel für die Teilchen mit
räumlich gerichteter Bindungsart zu finden. Hier stellt sich zunächst
die Tatsache entgegen, daß viele Teilchen eine unterschiedliche
Anzahl von Bindefähigkeiten besitzen.
Um diese Vielfalt übersichtlich zu ordnen, hat sich die Normung
anhand der Bindefähigkeit des Wasserstoff- oder Fluor-Atoms bewährt.
In diesem Zusammenhang fragen wir absichtlich nur nach der Fähigkeit,
ein Teilchen anzuknüpfen, nicht nach dem physikalischen Hintergrund
der chemischen Bindung. Eine Unzahl von Experimenten sind zu diesem
Normungszweck schon seit Beginn des letzten Jahrhunderts gemacht worden.
Alle diese experimentellen Ergebnisse wollen wir wiederum in einem
großen Gedankenexperiment zusammenfassen.
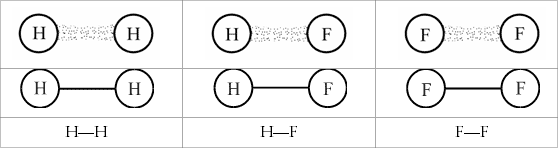 Abb. 3.6: Modellzeichnungen und Struktursymbole
für die Kopplung von Wasserstoff- und Fluor-Atomen
Abb. 3.6: Modellzeichnungen und Struktursymbole
für die Kopplung von Wasserstoff- und Fluor-AtomenEin Wasserstoff-Atom läßt sich sehr leicht mit einem weiteren
Wasserstoff-Atom stabil verknüpfen. Mit zwei Fluor-Atomen funktioniert
dies genauso, ebenfalls mit jeweils einem Wasserstoff-Atom und einem Fluor-Atom.
Die gerichteten Bindefähigkeiten dieser Atome koppeln sich gegenseitig,
im Modell können wir uns das wie in Abbildung 3.6 vorstellen.
Das läßt den Schluß zu, daß die Fähigkeiten
des Verknüpfens beim Wasserstoff-Atom und beim Fluor-Atom gleich sind.
Es darf wiederholt werden, daß die Fähigkeit gleich ist, es
ist nicht von Kräften oder ähnlichen physikalischen Begleitgrößen
die Rede. Ein analoges Beispiel könnte man heranziehen: Die gesetzliche
Bindefähigkeit eines Mannes zu einer Frau in den europäischen
Ländern ist eins, in den orientalischen Ländern kann die des
Mannes vier sein, die der Frau bleibt eins. Die Bindefähigkeit ist
also als Zuordnungsgröße zu verstehen, sie sagt nichts aus über
Kraft und Schönheit oder Zuwendung und Abneigung. Die Bindefähigkeit
ist auch hier lediglich eine ordnende, gesetzmäßige Größe,
die die Möglichkeiten des Verbindens angibt.
Entscheidend ist nun, daß sich diese Bindefähigkeit in Zahlen ausdrücken
läßt, wie wir es bereits getan haben. Dem Wasserstoff-Atom und
dem Fluor-Atom ordnen wir die Bindefähigkeit eins zu. Im Symbol können
wir das durch einen Bindestrich ausdrücken, der sich direkt von der zeichnerischen
Darstellung der gerichteten Bindefähigkeit ableiten läßt.
Wie Abbildung 3.6 es zeigt, sehen zwei gekoppelte Kugeln wie Hanteln
im Sport aus. Deshalb spricht man hier auch von einer Wasserstoff-Hantel,
Fluor-Hantel oder Fluorwasserstoff-Hantel.
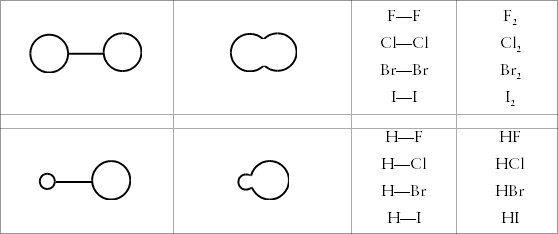 Abb. 3.7: Modellzeichnungen und Struktursymbole
für die Kopplung von Atomen der Normbindefähigkeit eins
Abb. 3.7: Modellzeichnungen und Struktursymbole
für die Kopplung von Atomen der Normbindefähigkeit einsWenn man für die einzelnen Atome nur die entsprechenden Buchstaben
verwendet, erhält man Struktursymbole der Moleküle. In steter
Erinnerung daran, daß es sich um eine Absprache der Chemiker handelt,
wollen wir diese Bindefähigkeit des Wasserstoffs und Fluors als Normbindefähigkeit
bezeichnen.
Die Kopplung anhand einer jeweils zusammenpassenden Normbindefähigkeit
bezeichnen wir als Normbindung, zu einer Normbindung müssen beide
Teilchen ihre Normbindefähigkeit beisteuern. Geben wir mit dem Atomsymbol
den Bindestrich an, der die Normbindefähigkeit eins anzeigt (H-, F-),
dann kann sogar ein Laie die in Abbildung 3.7 gezeigten Kombinationen finden.
In Modellbaukästen werden diese Normbindefähigkeiten oft durch
Druckknöpfe oder Verbindungsstäbchen symbolisiert.
Die Übertragung dieser Normung auf alle anderen Teilchen, die räumlich
gerichtete Bindefähigkeiten betätigen, gelingt dadurch, daß wir
experimentell in verschiedenen Verbindungen des Wasserstoffs und
des Fluors feststellen, wieviele Atome miteinander verknüpft sind.
Modellmäßig
untersuchen wir ein in seiner Bindefähigkeit unbekanntes Atom daraufhin,
wieviel Fluor- oder Wasserstoff-Atome maximal an das Atom zu koppeln
sind. Die Anzahl der verknüpften Fluor- oder Wasserstoff-Atome gibt
dann direkt die Normbindefähigkeit des untersuchten Teilchens an.
Zum Beispiel bindet ein Sauerstoff-Atom zwei Fluor- oder Wasserstoff-Atome.
Unabhängig von der exakten räumlichen Struktur, auf die wir später
genau eingehen wollen, läßt sich diese Teilchenkombination in
der Normbindesymbolik ohne weiteres angeben. Das Sauerstoff-Atom besitzt
demnach zwei Normbindefähigkeiten, das Stickstoff-Atom drei.
Zwei Sauerstoff-Atome lassen sich nun so kombinieren, daß sich die
beiden Normbindefähigkeiten gegenseitig zur Bindung absättigen.
Diese Sauerstoff-Hantel besitzt also zwischen den beiden Sauerstoff-Atomen
eine Bindung, die durch zwei Normbindungen beschrieben wird. Wir nennen
solch eine Bindung auch Doppelbindung im Gegensatz zur Einfachbindung der
Wasserstoff-Hantel. Kombinieren wir nach der gleichen Methode zwei Stickstoff-Atome,
dann vereinen sich die drei Normbindefähigkeiten zwischen den beiden
Stickstoff-Atomen. Wir erhalten eine Stickstoff-Hantel, deren Bindung wir
durch drei Normbindungen beschreiben. Wir nennen sie Dreifachbindung.
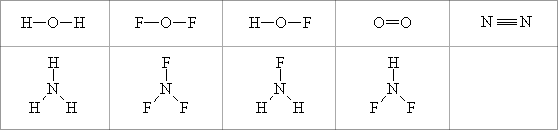 Abb. 3.8: Beispiele für die Verknüpfung
aus Atomen der Normbindefähigkeit zwei und drei
Abb. 3.8: Beispiele für die Verknüpfung
aus Atomen der Normbindefähigkeit zwei und dreiOb nun die in Abbildung 3.8 genannten, spielerisch erhaltenen neuen Kombinationen
existieren, muß man im Laboratorium entscheiden. In diesem Fall sind
sie durch das Experiment tatsächlich hergestellt oder gefunden worden.
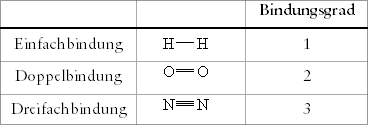
Stellen wir die Hanteln von Wasserstoff, Sauerstoff und Stickstoff
gegenüber, so unterscheiden sie sich in ihrer Bindung durch
die Anzahl der Normbindungen. Die Anzahl der für eine Bindung
verwendeten Normbindungen wird als Bindungsgrad bezeichnet. Dieser
Bindungsgrad, den man wegen der Normbindungen eigentlich Normbindungsgrad
nennen müßte, muß nicht immer ganzzahlig sein.
Die Bindefähigkeiten können sich oft recht eigenwillig
um das Teilchen herum verteilen. Die Summe der Normbindefähigkeiten,
also die gesamte Bindefähigkeit des Atoms, bleibt jedoch dabei
immer erhalten. Das garantiert das Funktionieren dieser Kombinationsmethode.
Machen wir uns diese an einigen Beispielen klar.
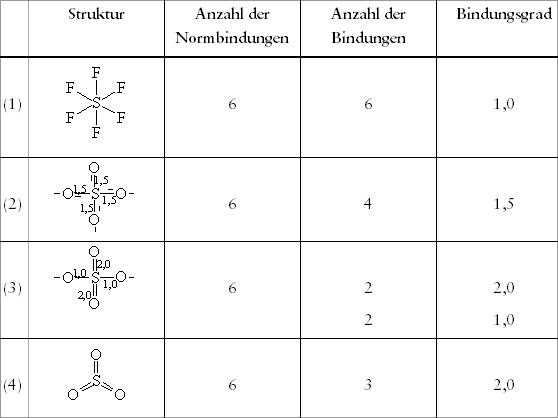 Tab. 3.1: Zusammenhang von Bindungsgrad und Normbindungen
am Beispiel des Schwefel-Atoms
Tab. 3.1: Zusammenhang von Bindungsgrad und Normbindungen
am Beispiel des Schwefel-AtomsEin Schwefel-Atom bildet meistens gerichtete Bindungen zum Sauerstoff-Atom aus, viele Experimente haben ergeben, daß die Summe der gerichteten Normbindefähigkeiten am Schwefel-Atom sechs beträgt. An ein Schwefel-Atom lassen sich also zunächst sechs Fluor-Atome anknüpfen. Sie sind völlig gleichmäßig im Raum um das Schwefel-Atom gebunden: vorn, hinten, links, rechts, oben, unten. Wenn man die um das Schwefel-Atom postierten Fluor-Atome durch gerade Linien zeichnerisch verbindet, erhält man als räumliches Gebilde einen Oktaeder. Er ist in Abbildung 3.4 räumlich abgebildet und in Tabelle 3.1 unter (1) symbolisiert.
Schwierigkeiten macht die Darstellung der gebrochenen Bindungsgrade in einem
Symbol. Man könnte natürlich die Länge des Normbindestrichs
festlegen, etwa 1 cm. Dann wäre der Bindungsgrad wie in Tabelle 3.2
durch 1,33 cm oder 1,75 cm darstellbar. Das kann man aber in der Praxis
nicht durchhalten, weder beim Symbolschreiben noch beim Lesen. Deshalb
schreibt man den Bindungsgrad, soweit er interessiert, als Zahl dazu oder
man kann ihn selbst ausrechnen, wenn man die Normbindefähigkeit des
zentralen Teilchens kennt.
Ein gebrochener Bindungsgrad ist allerdings nicht mit einem Modellbaukasten,
bei dem jede Normbindefähigkeit durch einen Druckknopf symbolisiert
wird darstellbar. 0,33 Druckknöpfe gibt es nicht!
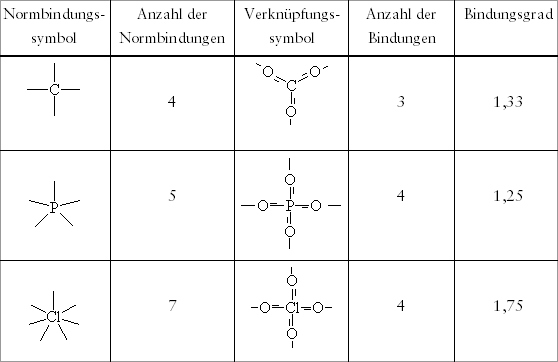 Tab. 3.2: Einige Beispiele zur Anzahl von Normbindungen
und zum Bindungsgrad
Tab. 3.2: Einige Beispiele zur Anzahl von Normbindungen
und zum BindungsgradWir werden uns im Laufe der kommenden Kapitel immer mehr mit der Symbolik beschäftigen müssen, mit der man über die Struktur von Teilchenverbänden informieren kann. Eine Hauptschwierigkeit für den Anfänger besteht darin, daß der geübte Chemiker seine Informationen um so mehr abkürzt, je klarer ihm die Sachlage ist. Verdeutlichen wir uns dies ausgehend von Abbildung 3.10 anhand verschiedener Symbole zur Kombination aus vier Sauerstoff-Atomen tetraedrisch um ein Schwefel-Atom.
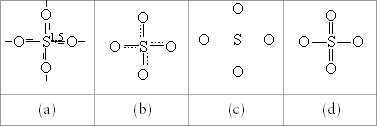
Der Informationsgehalt des Symbols nimmt von links nach rechts ab. Dem Symbol (a) entnimmt man sowohl den Bindungsgrad der Bindung als auch die Normbindefähigkeit des Schwefel-Atoms, also die experimentell nachgewiesene Tatsache, daß alle vier Sauerstoff-Atome gleich an das Schwefel-Atom angebunden sind. Aus der Information (b) geht hervor, daß die vier Atome in gleicher Weise an das Schwefel-Atom gebunden sind, der Bindungsgrad ist allerdings nicht zu erkennen. Das Symbol (c) besitzt den geringsten Informationsgehalt und läßt beliebige Interpretationen bezüglich der Normbindefähigkeit des Schwefel-Atoms zu. An Symbol (d) ist zwar die Normbindefähigkeit sechs zu erkennen, es unterstellt allerdings unterschiedliche Bindungen der Sauerstoff-Atome. Trotzdem wird häufig ein solch sachlich unzutreffendes Symbol verwendet, weil man es vorzieht, lieber mit ganzzahligen als mit gebrochenen Bindungsgraden zu arbeiten.
Es gilt hier in der Chemie wie überall: Je mehr die Person weiß, die man informieren will, desto weniger genau muß die Information ausfallen. Je weniger die Person weiß, desto genauer muß die Information sein. Je besser man sich in einem Landschaftsgebiet auskennt, desto weniger benötigt man eine gute Karte. Wer sich aber schlecht in einem Gebiet auskennt, benötigt eine sehr gute Information, eben eine sehr gute Landkarte.
![]()


